从诺和诺德的长效重组FactorVII的III期临床被叫停,到辉瑞宣布终止PCSK9单抗bococizumab的6个III期临床试验,免疫原性问题已经成为了生物制药中的“深水炸弹”。小编之前文章已介绍过免疫原性的产生原因与检测方法(戏说抗体和蛋白药物的免疫原性),今天就主要介绍一下临床前免疫原性的预测。
免疫原性预测
免疫原性问题在最初的序列设计时就应该考虑,虽然目前还没有针对这方面的标准或建议,但是计算机T细胞表位的预测以及体外的T细胞激活实验几乎成了免疫原性预测的“金标准”。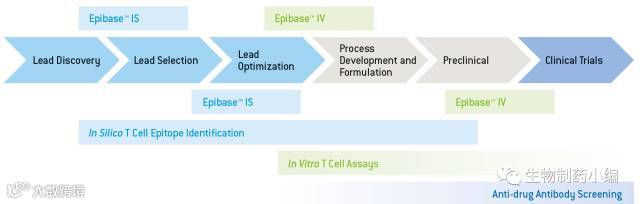
T表位预测 对于高亲和力的ADA的产生,必要的一步就是治疗蛋白上T细胞表位通过APCs上的MHC II类分子提呈给CD4+ T细胞,从而促进细胞因子的释放与B细胞产生抗体。因此治疗性蛋白上的T细胞表位对于免疫原性有一定影响。人MHC II分子是由HLA-DR, HLA-DP,HLA-DQ等基因编码的α/β异源二聚体,这些基因有着非常多的等位基因。一般认为HLA-DP和HLA-DQ与过敏原引起的T细胞反应以及ADA的形成关系不大,因此主要是HLA-DR在ADA的形成中发挥作用。T细胞表位依赖于线性肽段,长度在15-20个氨基酸,各种算法被开发出用于预测肽段与MHC II分子(主要是HLA-DR)的结合,见下图。
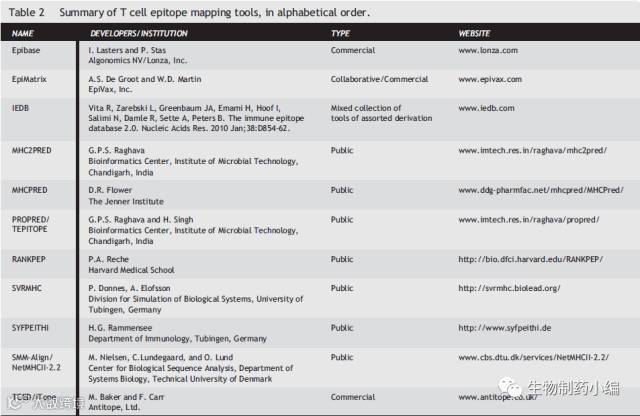
▲ T细胞表位预测工具
MAPPs assay(MHC-associated peptide proteomics)由于T细胞表位预测的是肽段与MHC复合物的结合能力,而不能够显示出蛋白药在体内被水解和提呈的情况,因此需要MAPPs实验进一步验证。具体实验步骤见图,简单来说,从健康人PBMC中分离得到CD14+单核细胞,经分化形成未成熟的DCs,再加入测试样品刺激后形成成熟的DCs,然后用偶联抗HLA-DR抗体的磁珠去捕获被HLA-DR提呈的肽段,最后经HPLC/MS鉴定。
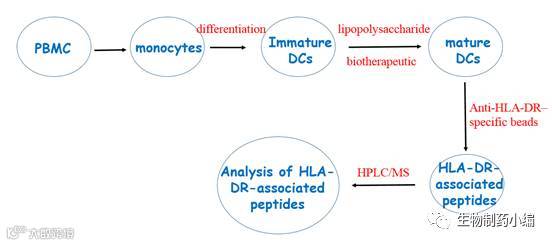
▲ MAPPs实验流程
T cell activation assay 尽管MAPPs鉴定出了所有潜在的T细胞表位,但是由于免疫显性现象的存在,并不是每一个T细胞表位都能有效的引起T细胞反应。T细胞激活实验能用来检测受试样品最终激活T细胞的能力。简单来说,DC细胞和CD4+ T细胞分别从正常志愿者的PBMC中分离出来,在体外培养(即DC:CD4 Assay),也可以直接使用PBMCs(即Whole PBMC Assay)。加入受试样品后,DC细胞能够提呈T细胞表位从而激活CD4+ T细胞。T细胞的激活可以通过多种方式来定量检测,例如通过3H-胸苷的组装来测定T细胞增殖,或者通过enzyme linked immunospot (ELISpot) 实验来检测IL-2的分泌。此外,最近通过流式技术分析T细胞上CD25的表达量也被用来检测T细胞的激活。这两种方法中,Whole PBMC Assay更灵敏,但是受试药品可能干扰T细胞的激活,而在DC:CD4 Assay中,DC与T细胞的比例并不是正常生理状态,因此会有更高的背景值。

▲ DC: CD4 T细胞激活实验流程
因为人体内的免疫反应过于复杂,从预测的T细胞表位到体外的T细胞激活就存在着很大差异。在了解了免疫原性预测的方法之后,不禁会有个想法,免疫原性预测到底靠谱不?预测结果与实际临床的免疫原性发生率有相关性么?
Secukinumab的免疫原性预测
为此,诺华的科学家们研究了Secukinumab与其他一些用于自身免疫疾病的抗体,对比了它们的免疫原性预测结果与实际临床免疫原性发生率。

▲ 几种单抗的ADA发生率
他们通过MAPPs实验发现了在Secukinumab和Ustekinumab中存在着更少的潜在CD4+ T细胞表位。

▲ 各抗体相对于adalimumab的MAPPs Cluster
同时在T细胞激活实验中,Secukinumab和Ustekinumab也表现出了更低的T细胞激活响应率。这些结果都显示了免疫原性预测结果与临床免疫原性发生率有相关性。

▲ 各抗体的T细胞激活响应率
Vatreptacogalfa的免疫原性预测
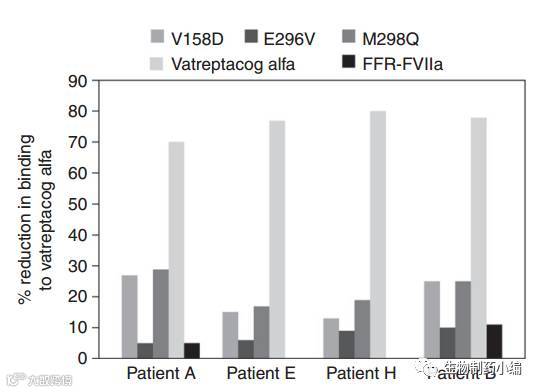
诺和诺德也在前不久也对他们的长效重组FactorVII,Vatreptacog alfa进行了免疫原性预测。Vatreptacog alfa与天然FactorVII相比,只发生了三个氨基酸替换,V158D,E296V以及M298Q。在临床III期实验中,8/72(11%)的患者出现了ADA,且4人ADA能与内源的FactorVII结合。通过结合实验以及计算机预测,发现含有E296V和M298Q的肽段与HLA-DR的亲和力比V158D高的多,且高亲和力是对于某些特定的HLA-DR分子而非所有的。

▲ 含有突变的肽段与HLA-DR分子的结合能力
接下来的MAPPs实验也证实了这一点,两次实验12/17(70%)和4/12(30%)的人中出现了含E296V与M298Q的肽段,而没有出现V158D肽段,并且这些人的HLA-DR分型与之前预测的高亲和力HLA-DR分型吻合。在T细胞激活实验中,含E296V或/与M298Q的肽段都能有效的激活T细胞,而V158D不能。这些结果都表明了E296V与M298Q可能是引起Vatreptacog alfa ADA的主要原因。此外,临床实验中的7个ADA阳性病人与18个ADA阴性病人进行了HLA的分型检测,发现7个ADA阳性病人的HLA-DR分型都与含E296V与M298Q的肽段有较强的亲和力,而在18个ADA阴性病人中,只有8个(44%)病人含有强亲和力的HLA-DR分型。虽然统计数目较少,也从一定程度上说明了强的T细胞表位可能与ADA的发生率存在联系。

▲ 含有不同突变肽段的T细胞激活响应率
但是值得注意的是,人体中免疫反应远比T细胞激活复杂,临床前免疫原性预测结果和临床试验ADA的发生率并不是线性相关的。除去分子序列,治疗性蛋白的CMC,制剂,病人的状态,给药方式等都会给免疫原性造成影响。还有各抗体的临床ADA发生率,由于测量方法的不同,取样时间的不同,不具备可比性。对于实验本身,比如T细胞激活的响应率都很低,因此实验结果可能会存在较大的变异性。而且T细胞的激活是与HLA-DR的分型密切相关的,因此需要实验样本尽可能多,符合人口的分布。最后免疫原性预测只能用于评价相对的免疫原性高低,如上面secukinumab的例子,在MAPPs和T细胞激活实验中,adalimumab和infliximab的结果就是相反的,但是和secukinumab和ustekinumab相比,大趋势还是存在的。因此能利用免疫原性预测帮我们筛选掉高ADA风险的分子就非常有意义。
此外,之前的报道发现Vatreptacog alfa中任意一个单突变都不能够像Vatreptacog alfa本身一样竞争其与ADA的结合,说明V158D,E296V以及M298Q三个突变对于ADA的生成都有贡献。这也暗示了除了T细胞表位,B细胞表位在可能ADA发生过程中也起到作用。由于B细胞表位主要依赖于构象结构,单独的B细胞表位不足以引起B细胞的激活,因此很难通过B细胞表位来预测免疫原性。同时与传统的老鼠或猴子模型相比,HLA转基因或者人免疫系统移植的老鼠可能在免疫原性预测上更有潜力,但是如何保证HLA的多样性与降低成本仍然是难题。希望在将来这些方法能够有所突破。
▲ 单独V158D, E296V, M198Q突变的FVIIa不能够完全竞争Vatreptacogalfa与ADA的结合
总的来说,现阶段精确预测临床免疫原性发生率是不可能实现的,但是临床前免疫原性预测(T/B表位预测以及体外T细胞实验)与临床免疫原性发生率表现出的近似相关性,能够帮助我们减少高免疫原性带来的风险,尽量避免这颗“深水炸弹”。希望能够尽早开发出更精确的方法,也希望人们引起重视,毕竟三期临床失败,不管对于药企、接受临床试验的志愿者还是急切盼望新药的病人,都是不能承受之重。
参考文献:
1. 戏说抗体和蛋白药物的免疫原性.
2. Preclinical Models Used for Immunogenicity Prediction of Therapeutic Proteins.
3. T-celldependent immunogenicity of protein therapeutics: Preclinical assessment andmitigation.
4. LonzaImmunogenicity Assessment Services.
5. Secukinumab,a novel anti–IL-17A antibody, shows low immunogenicity potential in human invitro assays comparable to other marketed biotherapeutics with low clinicalimmunogenicity.
6. Posthoc assessment of the immunogenicity of bioengineered factor VIIa demonstratesthe use of preclinical tools.
7. Changesin the amino acid sequence of the recombinant human factor VIIa analog,vatreptacog alfa, are associated with clinical immunogenicity.



