

结果
1.MPC1在NAFLD患者肝脏中上调且与脂肪沉积相关
为探究MPC1与NAFLD的关系,作者对43例NAFLD患者和7例正常肝脏患者的肝组织进行了MPC1的免疫组织化学染色。与正常组相比,NAFLD(NAS≤4)和NASH(NAS≥5)患者MPC1表达显著增加(图1A)。相关性分析显示,虽然MPC1表达与炎症、纤维化、ALT或AST无相关性(图1B),但与NAFLD患者肝脏脂肪变性的程度和百分比显著相关(图1C和D)。在HFD喂养18周的小鼠肝脏中,MPC1表达上调(图1E),qPCR和Western blotting验证了这一结果(图1F,G)。进一步研究也证明小鼠肝脏中MPC1表达与脂肪变性程度呈正相关(图1H)。此外,MPC1在高糖高脂喂养的小鼠(图1I,J)以及在油酸和棕榈酸处理的AML-12和HepG2细胞中的表达上调(图1K,L)。综上,作者的结果表明,MPC1的上调可能在NAFLD的发生和发展中发挥重要作用。
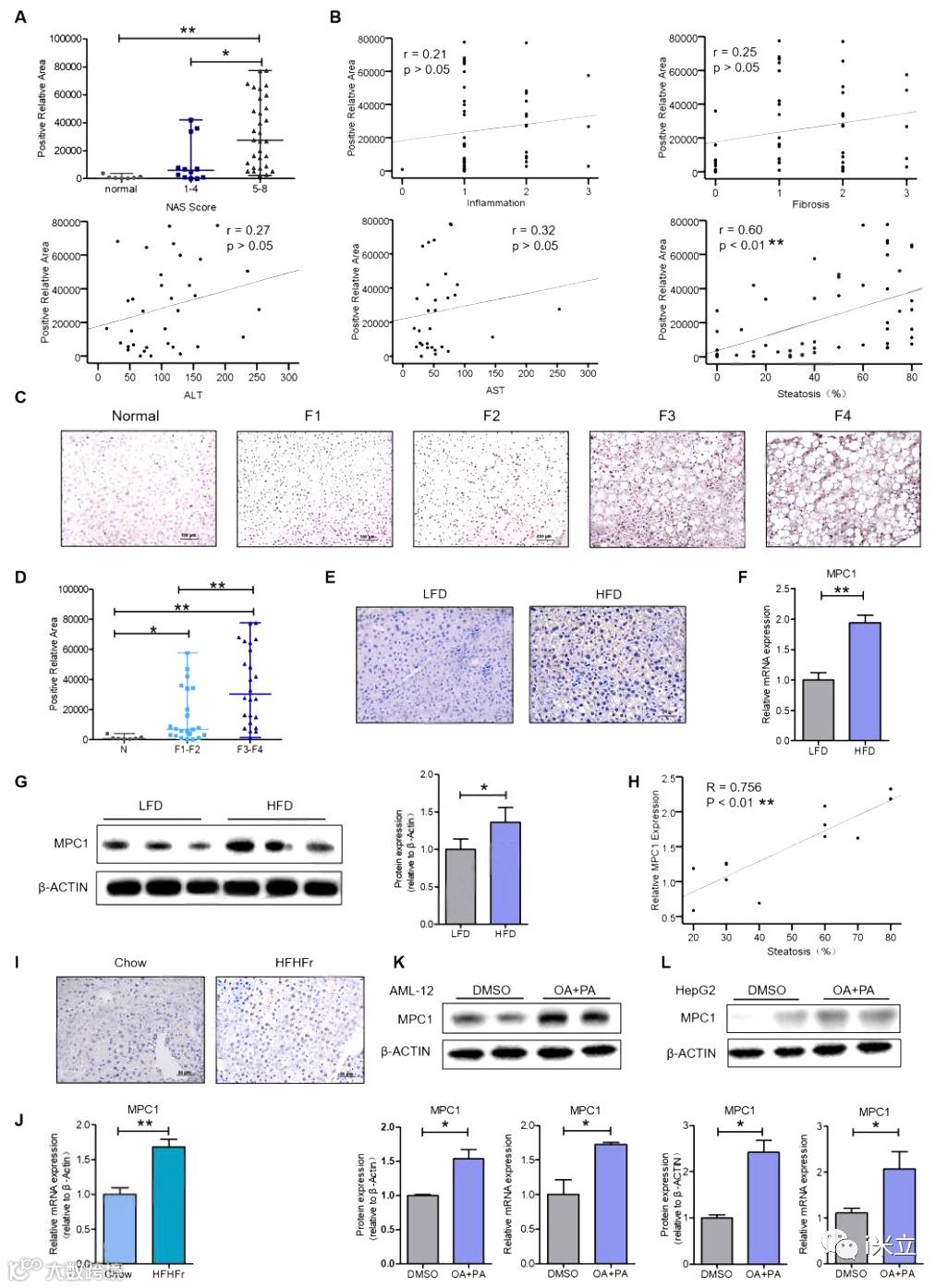
图1 MPC1在非酒精性脂肪肝病患者、小鼠和细胞模型中表达水平升高
2. MPC1敲除改善NAFLD肝脏脂质沉积
为了继续探索细胞内MPC1抑制对脂质代谢的影响,作者接下来使用正常小鼠AML-12肝细胞系在体外证实了他们的发现。MPC特异性抑制剂UK5099处理后,NEFAs和TG含量显前著降低(图2J,K)。ORO染色也显示,MPC抑制可显著减少AML-12细胞的基于先的结果,作者建立了MPC1+/-小鼠模型,并给予为期18周高脂饮食处理。与WT小鼠相比,LFD或HFD的MPC1+/-小鼠表现出体重减轻(图2A)。值得注意的是,喂食HFD的MPC1+/-小鼠肝脏体重比显著降低(TG水平和H&E染色显示MPC1+/-小鼠肝脏脂质沉积明显改善(图2F,G)。MPC1+/-小鼠肝脏NAS评分明显降低,脂肪变性程度改善(图2H,I)。这些数据表明MP图2B),血清TG浓度降低,高密度脂蛋白水平显著升高(图2C-E)。肝脏C1+/-小鼠肝脏脂质沉积减少。脂质沉积(图2L)。作者在HepG2细胞中也得到了相似的结果(图2M)。
综上,这些结果表明MPC1敲除可改善高脂饮食导致的过度脂肪堆积。

图2 MPC1敲除改善小鼠和细胞模型中肝脏脂肪堆积
3.抑制MPC1可不依赖于调控关键基因表达而减少肝脏脂质堆积
为了进一步探索MPC1敲除改善肝脏脂质堆积的机制,作者检测了脂质代谢通路中关键酶和转录因子的表达。与肝脏脂质堆积显著减少相反,MPC1+/-小鼠中大多数脂质代谢相关基因(Srebp1-c、Fasn、Acc等)的mRNA表达水平没有明显变化(图3A)。此外,除PGC1α外,DNL通路中大多数关键蛋白的表达水平,如FASN和ACC,也没有明显差异(图3B)。接下来,作者使用两种不同的siRNAs敲除AML-12细胞中的MPC1,这显著降低了MPC1的表达(图3C)。ORO染色以及NEFAs和TG含量定量显示,MPC1 siRNA处理减少了AML-12细胞的脂质积累(图3D)。为了系统地评估MPC1敲除的效果,作者进行了无标记蛋白质组学研究。结果表明,MPC1 siRNA处理不改变脂质代谢途径中的蛋白表达(图3E)。作者进一步验证了蛋白质组学结果,发现大多数关键DNL基因的表达不受影响(图3F, G)。
这些结果证实,MPC1的下调可以减少肝脏脂质积累,而不影响脂质合成相关关键基因的表达。
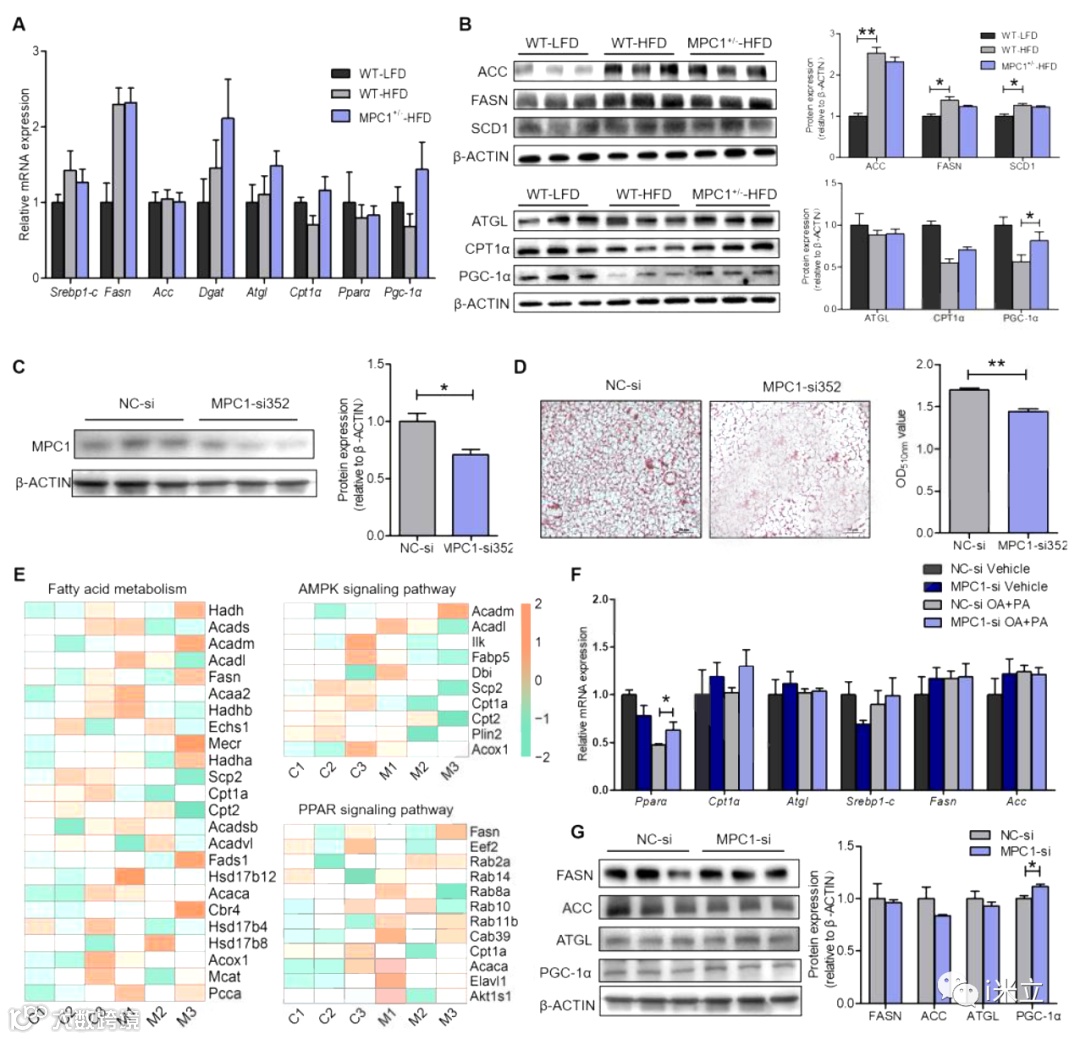
图3 药物或基因抑制MPC1不依赖于调控关键基因表达而抑制脂代谢
4. MPC1敲除增加乳酸水平和改变肝脏蛋白乳酸化
作者对WT和MPC1+/-小鼠血清进行非靶向代谢组学分析,发现差异代谢产物在氨基酸相关通路中富集(图4A)。MPC1敲除导致乳酸水平显著升高,这可能与丙酮酸积累引起的乳酸合成激活有关(图4B)。此结果伴有肝脏LA水平升高(图4C)。在MPC1敲除后,NAFLD小鼠肝脏中的蛋白质乳酸化水平显著改变,某些蛋白质的乳酸化增加(图4D)。
作者对MPC1+/-和WT小鼠的肝脏进行了乳酸化蛋白质组学研究。作者鉴定出528个蛋白和1526个修饰位点,其中39个蛋白和47个位点在MPC1敲除后发生差异修饰(图4E, F)。在COG功能分类中,差异乳酸化蛋白富集在“代谢过程”和“生物调节”等生物过程中,特别是“能量产生与转换”和脂质运输与代谢”两类(图4G)。KEGG功能通路分析也显示了胰岛素敏感性和脂肪酸代谢通路的富集,这与NAFLD的发展有关(图4H)。然而,由于在MPC1+/-小鼠肝脏中未观察到脂代谢相关基因表达的变化(图3A),作者假设其他蛋白质的乳酸化参与了脂代谢的调节。在乳酸化差异蛋白中,MPC1敲除后FASN的三个乳酸化位点(K528、K673和K1071)增加(图4I)。
考虑到FASN在脂肪酸合成中的重要性,作者认为FASN乳酸化是MPC1调节肝脏脂质代谢的一种新机制。

图4 MPC1调节肝脏代谢和蛋白乳酸化
5.K673乳酸化降低FASN活性和肝脏脂质堆积
作者比较了FASN蛋白序列的同源性,发现残基528和673附近的序列在人和小鼠之间是同源的(图5A),这表明FASN在这些位点的乳酸化可能是保守的。免疫印迹进一步证实了小鼠肝脏以及AML-12和HepG2细胞中的FASN乳酸化(图5B, C)。
为了确定MPC1抑制引起的FASN乳酸化是否会影响其活性,作者首先测量了MPC1下调肝细胞中的FASN活性,发现MPC1缺乏导致FASN活性显著降低(图5D)。有趣的是,作者还观察到NAFLD肝脏中FASN乳酸化降低,这一作用可通过MPC1敲除逆转(图5E)。总之,作者认为乳酸化可能抑制FASN活性,并有助于调节脂质代谢。
因此,作者为FASN的三个乳酸化位点生成了flag标记的抑制(MR)和过表达(MT)突变体。MT突变体的FASN活性明显低于WT FASN(图5F)。MT突变体过表达后NEFAs和TG含量显著降低(图5G, H),这与ORO染色结果一致(图5I, J)。在OA+PA处理的NAFLD模型细胞中也有类似的结果(图5I, J)。
作者对人类FASN的结构进行了建模,发现K528和K673位点都位于乙酰辅酶a和丙二酰辅酶a转酰基酶(MAT)亚基。K673位点与MAT亚基(His683)催化活性位点之间的空间距离相对较小,这提示K673很可能影响FASN活性(图5K)。因此,作者为每个乳酸化位点产生突变体,发现K673T的酶活性最低(图5L)。TG含量和ORO染色显示,无论正常或NAFLD状态,K673T过表达细胞均存在严重的脂质堆积缺陷(图5M-O)。
这些数据表明,K673乳酸化可显著抑制FASN活性,减少肝细胞脂质积累。

图5 FASN K673乳酸化介导肝脏脂肪堆积

图6 MPC1通过乳酸水平调节FASN乳酸化
在之前的研究中,作者提出了一种以乳酸为基础的调控模式,通过抑制MPC1提高乳酸水平来调节FASN乳酸化,减少肝脏脂质积累。然而,据报道乳酸能激活肝脏的炎症过程。为了确认乳酸水平升高是否会加重肝脏炎症,作者检测了MPC1+/-小鼠肝脏的炎症,发现M1巨噬细胞标记物(Cd11c和iNosA)的mRNA表达明显降低(图7A, B),而M2标记物(Arg1和Cd206)的mRNA表达明显升高(图7B)。IL-1β的免疫荧光和F4/80的免疫组化也显示MPC1敲除后整体肝脏炎症得到控制(图7C)。这些结果表明,尽管乳酸水平升高(图4C), MPC1+/-小鼠的肝脏炎症并未升高。值得注意的是,MPC1+/-小鼠肝脏中的巨噬细胞表现出抗炎表型。在MPC1敲除的AML-12细胞中,TNF-α和IL-1β蛋白水平以及外分泌细胞因子和炎症因子的mRNA水平显著降低(图7D, E)。然后作者用MPC1敲除的肝细胞上清培养RAW264.7细胞,发现巨噬细胞M2极化明显,炎症因子表达降低(图7F)。此外,由于呼吸链相关基因拷贝数的增加和Sirt1-Drp1轴mRNA表达的降低(图7G, H),作者认为MPC1的下调通过抑制过度的线粒体呼吸来减弱线粒体损伤。
总之,这些结果表明,尽管MPC1抑制增加了肝脏乳酸水平,但它可能通过影响线粒体功能和Kupffer细胞来抵消乳酸的促炎作用,从而控制肝脏炎症。

图7 MPC1缺乏保护肝脏免于炎症
结论
在NAFLD患者中,MPC1表达与肝脂沉积呈正相关。高脂饮食喂养的MPC1+/-小鼠肝脂积累减少,但脂质合成相关基因的表达无变化。MPC1敲除通过调节肝细胞内乳酸水平影响了多种蛋白质的乳酸化,尤其是脂肪酸合酶(FASN)的乳酸化。FASNK673位点的乳酸化抑制了FASN的活性,从而介导了MPC1对肝脂沉积的下调。此外,虽然MPC1敲除导致乳酸积累,但由于线粒体保护和巨噬细胞极化,炎症水平得到控制。
总之,本研究阐明了MPC1在调节非酒精性脂肪肝病中的重要作用并揭示了FASN乳酸化相关机制,为治疗非酒精性脂肪肝病提供了依据。

点击关注我们



