
参与长江三角洲区域(沪苏皖浙-市三省)医疗器械注册人制度试点的委托范围和受托范围是什么?
位于长江三角洲区域内的医疗器械注册申请人可以委托21个试点省份内具备相应生产能力的企业生产用于医疗器械注册型式检验的样品或批量生产拟上市销售的医疗器械成品。注册人可以委托21个试点省份内符合条件的医疗器械生产企业生产已获证产品。建议医疗器械注册申请人或注册人优先选择长江三角洲区域内第二二、第三类医疗器械生产企业进行委托生产。
位于长江三角洲区域内的符合条件的企业可以接受21个试点省份内注册申请人或注册人的受托生产。建议长江三角洲区域内具备条件的第二、第三类医疗器械生产企业积极参与全国试点范围内医疗器械注册申请人或注册人的受托生产。
江苏省医疗器械注册人制度试点的办理流程是怎样的?
江苏省注册申请人委托21个试点省份内具备相应生产能力的企业生产的,首先申请医疗器械产品注册,取得医疗器械注册证。然后受托生产企业办理受托备案,取得受托生产备案凭证。最后受托生产企业申请受托生产许可(开办) 或生产许可变更,取得医疗器械生产许可证,即可进行委托生产。若注册申请人与受托生产企业都位于江苏省的,可申请或者变更申请合并检查。具体流程如下图1。
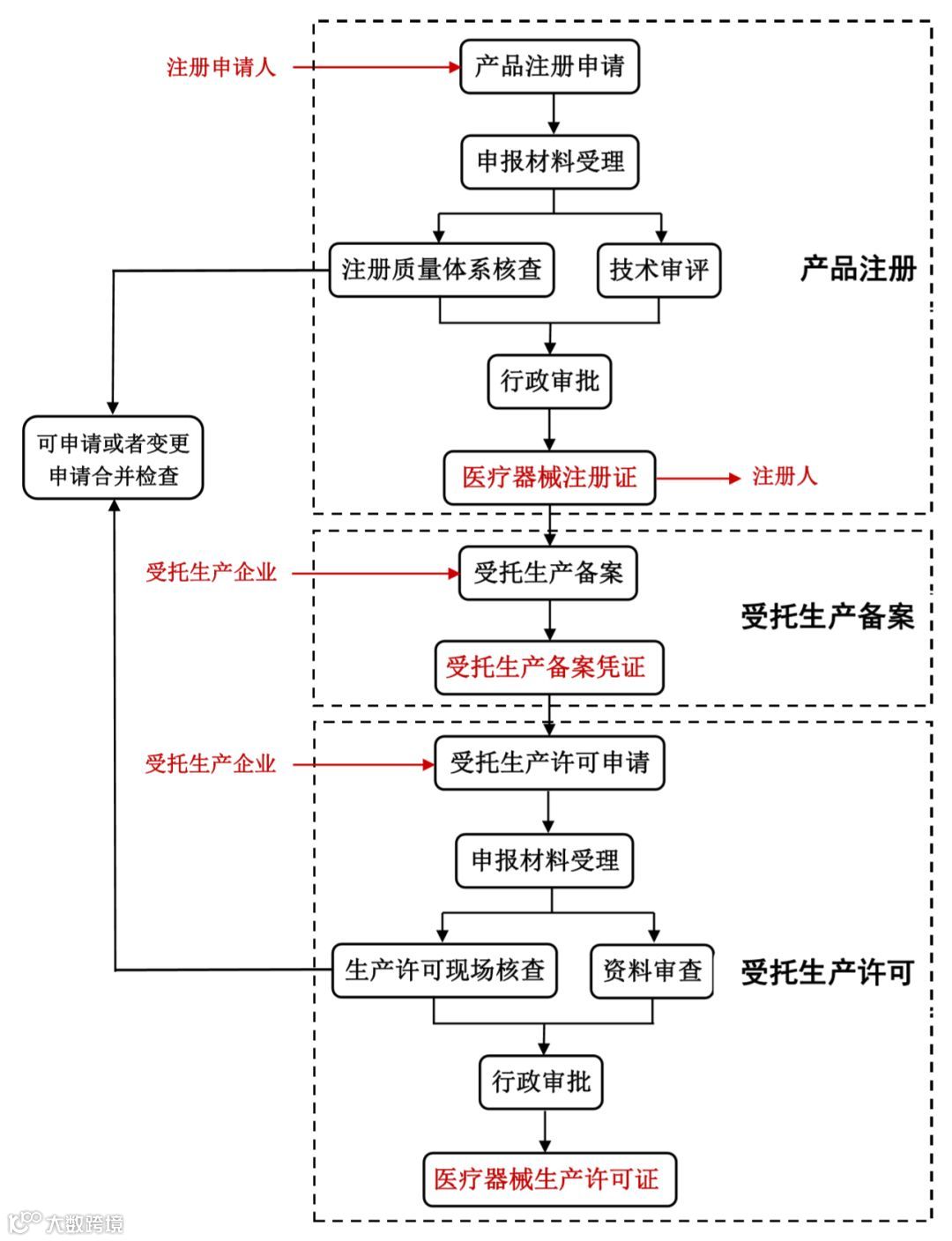
图1.江苏省医疗器械注册人制度试点办理流程及申报主体
(未取得注册证的情况)
注册人已经获得医疗器械注册证并需要委托生产的,受托生产企业首先办理受托备案,取得受托生产备案凭证。然后受托生产企业申请受托生产许可(开办)或生产许可变更,取得医疗器械生产许可证。最后,注册人申请医疗器械注册证登记事项变更,取得医疗器械注册证变更文件。具体如下图2。
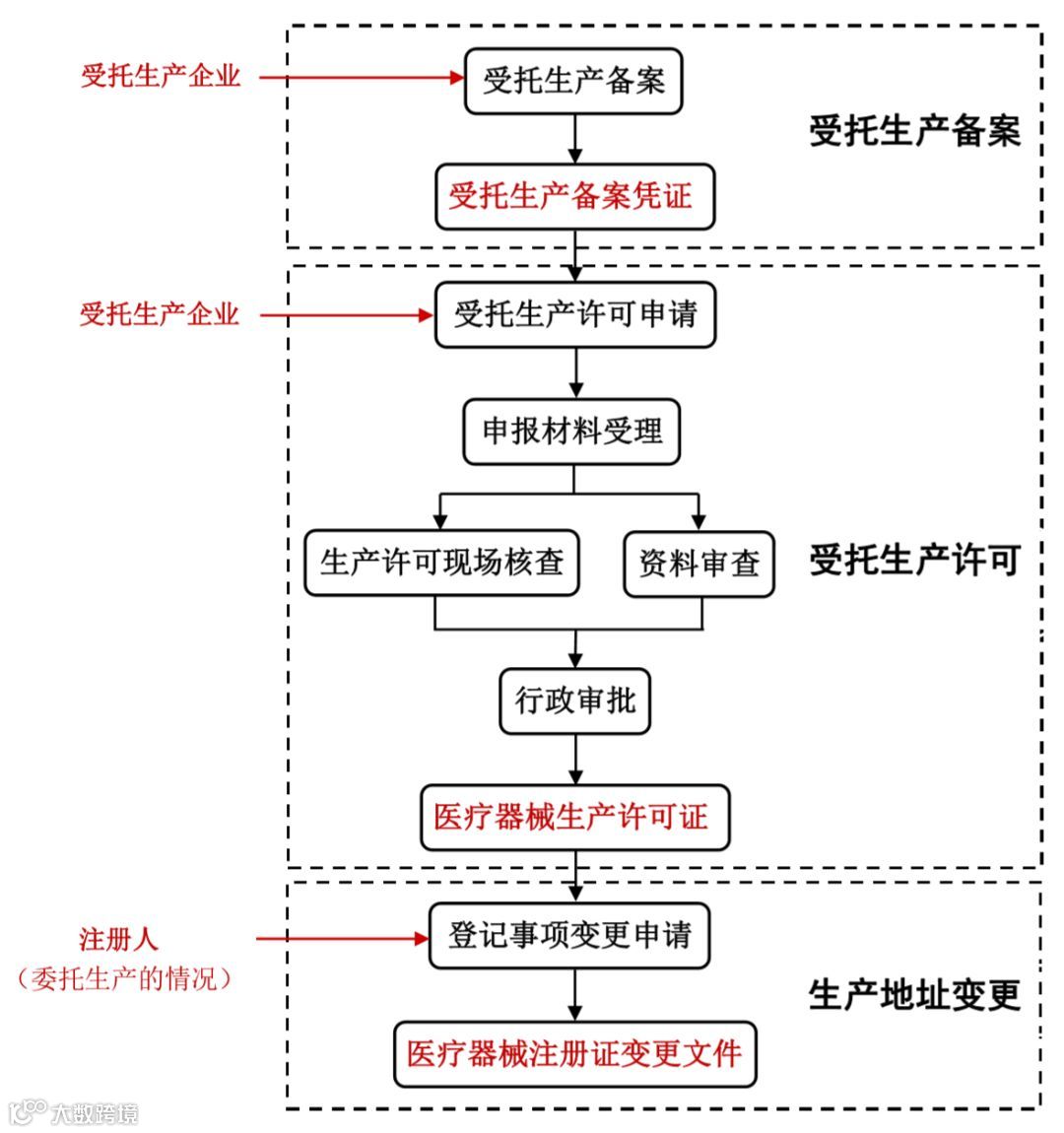
图2.江苏省医疗器械注册人制度试点办理流程及申报主体
(已取得注册证的情况)
关于产品注册、生产许可的申报要求可以在省局网站政务服务一-办事指南栏目中查看, 具体网址如下:
http://www.jszwfw.gov.cn/jszwfw/bscx/itemlist/fr_index.do?webId=1&themid=&deptid=320000SY#fw_jump
不同许可事项申请表已经上传更新版本,需要提交材料的请至网站下载并使用最新版本,以下提供部分许可事项办理流程材料要求的网址:
江苏省第二类医疗器械拟上市产品注册
http://wwwjszwfw.gov.cn/jszwfw/bscx/itemlist/bszn.do?webld=' 1&iddept yw_ inf=7bff9c5195e9433e8382769aa183947a&ql kind=01&iddept _ql inf=433&iszx=
江苏省第二类体外诊断试剂拟上市产品注册
http://www.jszwfw.gov.cn/jszwfw/bscx/itemlist/bszn.do?webId=1&iddept_yw_inf=5abdda919be0429994efa59d4a79488a&ql_kind=01&iddept_ql_inf=433&iszx=
开办第二、三类医疗器械生产企业
http://www.jszwfw.gov.cn/jszwfw/bscx/itemlist/bszn.do?webId=1&iddept_yw_inf=6948a9afa8e344edb41d69331fae7243&ql_kind=01&iddept_ql_inf=434&iszx=
医疗器械生产许可证许可事项变更
http://www.jszwfw.gov.cn/jszwfw/bscx/itemlist/bszn.do?webId=1&iddept_yw_inf=ca142901abe340a290b130f4f0a125c7&ql_kind=01&iddept_ql_inf=434&iszx=
制度试点实施允许委托生产产品范围包括哪些?
制度试点实施允许委托生产产品范围包括第二类、三类医疗器械;属于原国家食品药品监督管理总局发布的禁止委托生产医疗器械目录的产品,原则上不列入试点范围。值得注意的是,第一类医疗器械不包含在试点范围内。
注册申请人委托生产的,申报第二类医疗器械注册时, 除符合《国家食品药品监督管理总局关于公布医疗器械注册申报资料要求和批准证明文件格式的公告(2014年第43号)》或《国家食品药品监督管理总局关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告(2014年第44号)》等要求外,还需要根据《江苏省医疗器械注册人制度试点工作实施指南(试行)》提交哪些资料(见《指南》第四条) ?
(1)受托生产企业的营业执照复印件;
(3) 委托生产合同复印件(明确双方合作生产方式,委托方和受托方的权利、义务与责任,产品验收标准,产品损害赔偿,合同终止条件等) ;
(4) 现场考核评估报告(注册申请人对受托生产=企业的生产条件、技术水平、 质量管理情况进行现场考核评估,阐述该受托企业与所合作品种的匹配性,以及台作关系确立后的定期审核计划) ;
(5) 委托生产质量协议复印件(明确委托生产的范围,双方在产品质量实现的全过程中各自的质安全责任、权利和义务,质量管理体系的要求,产品的性能、生产、质控要求,委托生产的变更控制与审批,双方发生分歧的解决等) ;
(6) 知识产权保护协议复 印件(明确双方在知识产权保护方 面各自的的责任、权利和义务) ;
(7) 转移文件清单 (例如技术要求、生产工艺、原材料要求、说明书和标签等技术文件已有效转移给拟受托生产企业,并形成文件清单)。
符合条件的集团公司向省局办理内部医疗器械注册人变更的,需要根据《江苏省医疗器械注册人制度试点工作实施指南(试行)》提交哪些资料(见《指南》第七条) ?
(1)双方隶属于同一集团公司的股权证明复印件;
(2) 转移文件清单(例如技术要求、生产工艺、原材料要求、说明书和标签等技术文件已有效转移给拟受托生产企业,并形成文件清单) ;
(3) 明确变更前已上市产品质量责任主体的协议/合同复印件;
(4)承诺生产地址、生产条件和技术要求等生产要素不发生改变的保证声明;
(5) 对变更过程及变更后果承担法律责任的保证声明,以及与集团总公司签订的担保协议复印件;
(6) 43号公告或44号公告中登记事项变更要求的其他资料。以上(1)至(5)资料均需变更双方同时签章。符合要求的,省局参照登记事项变更程序办理。
注册人委托生产的,托生产企业需向省办理受托生产备案,备案时应当根据《江苏省医疗器械注册人制度试点工作实施指南(试行)》提交哪些资料(见《指南》第十条) ?
(1) 医疗器械受托生产备案表;
(2) 受托生产的《医疗器械注册证》复印件;
(3) 注册人的营业执照复印件;
(4) 受托生产企业的营业执照复印件;
(5) 委托生产合同;
(6) 委托生产质量协议复印件;
(7) 受托生产企业的《医疗器械生产许可证》复印件(如有) ;
(8)受托生产企业具备相应生产能力的证明材料(例如受托生产企业质量管理体系情况证明文件) ;
(9) 经办人授权证明。
我局负责对提交的资料进行审核,评估受托生产企业是否具备受托生产条件,比如受托生产企业的人员管理、生产厂房、设施设备是否与受托生产产品的生产规模和品种等相匹配。
受托生产企业向省申请受托生产许可或生产许可变更的,除应当符合省局对二、 三类医疗器械生产许可申报资料的要求外,还需要根据《江苏省医疗器械注册人制度试点工作实施指南(试行)》提交哪些资料(见《指南》第十一条) ?
(1)注册人营业执照复印件;
(2) 受托生产产品的《医疗器械注册证》复印件;
(3) 受托生产产品的产品技术要求复印件;
(4)受托生产产品拟采用的说明书和标签样稿;
(5) 《受托生产备案凭证》 复印件;
(6) 委托生产合同复印件;
(7) 委托生产质量协议复印件;
(8) 知识产权保护协议复印件。
注册申请人委托生产的,注册质量管理体系核查范围还包括哪些方面?
注册申请人委托生产的,原则上应当对注册申请人及受托生产企业的质量管理体系同步进行现场核查。注册质量管理体系核查范围还包含以下几种情况:
(1) 同一注册申请人委托多家企业生产的,应当对注册申请人以及相关受托生产企业进行现场核查,
(2)注册申请人仅为样品研发主体,生产工艺建立和验证、设计转换均在受托生产企业完成的,应当对注册申请人研发地址和受托企业生产地址进行同步核查;
(3) 注册申请人委托外部机构进行设计开发的,注册体系核查可以根据情况对受托研发企业进行延伸核查。
(4)根据受托生产企业情况对关键物料或者关键工序/特殊过程的供应商进行延伸核查。
(5) 注册申请人委托本省内企业生产的,注册质量管理体系现场核查可与生产许可申请或者变更申请合并检查。
注册申请人委托生产的,注册质量管理体系核查除需按照《医疗器械生产质量管理规范》要求外,还需重点关注哪些方面?
对于参与试点的医疗器械注册申请人和受托生产企业在体系核查重点上与原来有所区别:
(1) 注册申请人具备承担医疗器械质安全责任的能力;
(2) 注册申请人对受托生产企业进行质量管理体系评估、审核和监督的能力;
(3) 注册申请人对委托生产产品的技术文件、生产工艺、设计变更等有效转移情况;
(4) 注册申请人所选择的受托生产企业具有持续稳定生产合格受托产品的能力。



