
为进一步规范医疗器械技术审评工作,国家药监局器审中心组织制定了《医用电子直线加速器技术审评要点》《腹腔内窥镜手术系统技术审评要点》《食道支架产品注册技术审评要点》《3D打印椎间融合器技术审评要点》《预充式导管冲洗器技术审评要点》《新型冠状病毒突变株检出能力评价技术审评要点》《髋关节假体同品种临床评价技术审评要点》等7项技术审评要点,详情如下:
本审评要点旨在指导注册申请人对医用电子直线加速器产品注册申报资料的准备及撰写,同时也为技术审评部门审评注册申报资料提供参考。
本审评要点是对医用电子直线加速器产品的一般要求,不包含临床评价内容,注册申请人应依据产品的具体特性确定其中内容是否适用,若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容进行充实和细化。
一、适用范围
本审评要点适用于医用电子直线加速器产品注册,按现行《医疗器械分类目录》,该类产品分类编码为05-01-01,管理类别为三类。
二、基本要求
(一)申报资料要求
参照《关于公布医疗器械注册申报资料要求和批准证明文件格式的公告(2021年第121号)》提交。
(二)指导原则适用情况
见附录1。
(三)标准适用情况
见附录2。
三、审评主要关注点
参照相关法规、规章、指导原则、标准,结合下列关注点开展技术审评。
(一)产品类别
《医疗器械分类目录》2017版05放射治疗器械,一级产品类别:01放射治疗设备,二级产品类别:01医用电子加速器。作为第三类医疗器械管理。
(二)器械描述
1.产品描述
预期用途、工作原理的介绍,产品技术特性及临床验证结果应支持申报的预期用途。
外观构造,整个系统的完整描述,包括系统设计以及各部件之间相互连接的图形化描述。
设备硬件的完整描述,包括所有组成部分。应给出有标记的图示(如图表、照片和图纸),清楚地标识关键部件/组件,其中包括充分的解释来方便理解这些图示。
与设备物理性能相关的设备属性的完整描述。描述应包含整个图像系统及系统各部件的技术特性和规范。系统整体性能参数,产品各部分工作原理和性能参数。
相对于市场上同类常规产品的创新性技术、设计和应用的介绍。
2.型号规格
对于存在多种型号规格的产品,应当明确各型号规格的区别。应当采用对比表或带有说明性文字的图片、图表,描述各种型号规格的结构组成(或配置)、功能、产品特征和运行模式、技术参数等内容。
3.研发历程
阐述申请注册产品的研发背景和目的。如有参考的同类产品或前代产品,应当提供同类产品或前代产品的信息,并说明选择其作为研发参考的原因。
4.与同类和/或前代产品的参考和比较
列表比较说明申报产品与同类产品和/或前代产品在工作原理、结构组成、制造材料、性能指标、作用方式,以及适用范围等方面的异同。
(三)产品技术要求及检测报告
1.产品技术要求
产品技术要求应符合《医疗器械产品技术要求编写指导原则》要求。性能指标和安全要求应包含加速器部分、KV级X射线成像影像引导装置(如含)、 MV级X射线成像影像引导装置(如含)、多元限束装置(如含)、呼吸门控(或接口)(如含)或其它呼吸追踪方式(如含)、治疗计划系统(如含)、治疗记录和验证系统(如含)、软件控制系统功能等要求。
2.检测报告
(1)检测典型性选择
应选择功能最全,最具典型性的产品进行检测。不能互相涵盖时应分别检测。
不同能量分档应分别检测。
普通剂量率模式、高剂量率(非均整)模式应分别检测。
多叶光栅结构差异较大的,应分别检测。普通多叶光栅、高精度小多叶光栅,应分别检测。
影像引导系统:发生器不同应分别检测,探测器不同应分别检测。
如果治疗床的承重大于135kg,应按实际承重检测。
(2)电磁兼容检测
产品的所有组成部分(包括选配件、不同配置),所有申报型号,都应送检。检测机构可对送检型号、配置进行分析;选取典型型号检测,检测报告中应阐述典型型号、配置的选择理由。
工作模式的选择:待机模式、不同射线(X射线、电子线)、不同的能量分档、不同的治疗模式、不同组件的运动状态(静止、运动)、图像引导装置的不同工作模式、多元限束装置的不同运动模式、呼吸门控的工作模式等均应进行检测。
(四)研究资料
根据申报产品适用范围和技术特征,提供非临床研究综述,逐项描述所开展的研究,概述研究方法和研究结论。根据非临床研究综述,提供相应的研究资料,各项研究可通过文献研究、实验室研究、模型研究等方式开展,一般应当包含研究方案、研究报告。采用建模研究的,应当提供产品建模研究资料。
具体要求参照《关于公布医疗器械注册申报资料要求和批准证明文件格式的公告(2021年第121号)》和本文第二章中列出各指导原则中的相关要求。
1.性能研究
性能指标应包含功能性、安全性指标以及与质量控制相关的其他指标。
量效关系和能量安全研究:应当提供量效关系和能量安全性研究资料,提供证明治疗参数设置的安全性、有效性、合理性,以及除预期靶组织外,能量不会对正常组织造成不可接受的伤害的研究资料。
联合使用:如申报产品预期与其他医疗器械、非医疗器械产品联合使用实现同一预期用途,应当提供证明联合使用安全有效的研究资料,包括互联基本信息(连接类型、接口、协议、最低性能)、联合使用风险及控制措施、联合使用上的限制,兼容性研究等。
2.电气系统安全性研究
应当提供电气安全性、机械和环境保护以及电磁兼容性的研究资料,说明适用的标准以及开展的研究。
3.辐射安全研究
应当提供辐射安全的研究资料,包括:
(1)说明符合的辐射安全通用及专用标准,对于标准中的不适用条款应详细说明理由;
(2)说明辐射的类型并提供辐射安全验证资料,应确保辐射能量、辐射分布以及其他辐射关键特性能够得到合理的控制和调整,并可在使用过程中进行预估、监控。
(3)提供减少使用者、他人和患者在运输、贮存、安装、使用中辐射吸收剂量的防护措施,避免误用的方法。应当明确有关验收和性能测试、验收标准及维护程序的信息。
4.软件研究
软件研究应按照《医疗器械软件注册技术审查指导原则》、《人工智能医疗器械注册审查指导原则》的要求提交研究资料。软件描述文档应涵盖本产品的全部软件(包括独立软件和软件组件)。产品如包含治疗计划系统、治疗记录与验证系统、治疗管理系统的软件也应包含在描述文档中。
涉及网络安全的产品应按照《医疗器械网络安全注册技术审查指导原则》的要求提交研究资料。
5.生物学特性研究
含有患者直接或间接接触的器械,应当进行生物学评价。
6.清洁、消毒研究
使用者清洁和消毒:应当明确推荐的清洗和消毒工艺(方法和参数)、工艺的确定依据以及验证的相关研究资料。
7.动物试验研究
如申报产品和已上市同类产品相比工作原理、作用机理无明显差异,不需要动物试验资料。如有新的工作原理、作用机理的产品申报,可参照《医疗器械动物试验研究技术审查指导原则》(第一部分:决策原则)确认是否需要进行动物试验。开展动物试验时需参照《医疗器械动物试验研究技术审查指导原则》(第二部分:实验设计、实施质量保证)相关要求。
8.稳定性研究
(1)使用稳定性
应提供医用电子加速器使用期限的研究资料。关键部件、易损部件的使用期限可单独确定,并提供研究资料。
提供使用稳定性/可靠性研究资料,证明在生产企业规定的使用期限/使用次数内,在正常使用、维护和校准(如适用)情况下,产品的性能功能满足使用要求。
(2)运输稳定性
应当提供运输稳定性和包装研究资料,证明在生产企业规定的运输条件下,运输过程中的环境条件(例如:震动、振动、温度和湿度的波动)不会对医疗器械的特性和性能,包括完整性和清洁度,造成不利影响。
(五)非临床文献
提供与申报产品相关的已发表的非临床研究(如尸体研究、生物力学研究等)文献/书目列表,并提供相关内容的复印件(外文应同时提供翻译件)。如未检索到与申报产品相关的非临床文献/书目,应当提供相关的声明。
(六)说明书
关注以下内容:
1.制造商应根据医用电子加速器的具体功能,确定其临床适用范围,并明确其绝对禁忌症和相对禁忌症。
2.治疗过程中,有关电子辐射的防护措施,应提示使用者特别注意。
3.使用人员资质要求:说明书中应对使用人员的资质和培训给出具体要求。
4.应说明关键部件更换周期、维护周期。强放射性部件的更换、临时储存及维护要求。
5.应当明确推荐的清洁、消毒和灭菌方法。重复使用的部件应当在说明书中明确重复使用的处理过程,包括清洁、消毒及灭菌的方法和重复使用的次数或者其他限制。
6.应有专门的章节列出医用电子加速器的主要技术指标(包括附录Ⅲ中要求的随机文件应该说明的技术指标),或提供列表文件说明所有技术指标的位置。
(七)其他注意事项
1.产品名称规范
参照《医疗器械分类目录》,名称规范描述为:医用电子直线加速器。
2.适用范围规范描述
应明确提供的射线种类(X射线/电子线),具体功能,如是否可实现立体定向治疗、是否可实现调强、是否有图像引导、是否包含呼吸门控等功能。
该类产品通常适用于头颈、颅内、胸腹、四肢实体恶性肿瘤和部分良性肿瘤(和病灶)的放射治疗。对于良性肿瘤和功能性疾病,只能用于放射治疗临床应用成熟、疗效确切的良性肿瘤和功能性疾病的治疗(同时应根据申报产品技术特点和能实现的放疗技术确认)。具体适应症应由临床专家根据实际情况确定。
3.注册单元划分
原则上以产品的技术原理、结构组成、性能指标和适用范围为划分依据。
(1)技术原理不同
例如:加速方式不同(行波、驻波)(直线、回旋)应划分为不同的注册单元。
(2)主要组成部件、设计结构不同
例如:加速管的设计结构不同,影像验证系统不同、机架结构设计不同(C型、螺旋断层)应划分为不同的注册单元。
(3)主要性能指标差异较大,应划分为不同的注册单元。
(4)预期用途差异较大,例如:专门用于立体定向放射治疗的设备和普通放疗的设备应划分为不同的注册单元。
(5)多叶光栅注册单元划分
内置多叶光栅不建议单独申报,应和加速器设备一起申报。外置多叶光栅可单独申报,也可和加速器系统一起申报。
四、医疗器械安全有效基本要求清单适用性
见附录3。
附录1:指导原则适用情况
指导原则名称 |
适用情况 |
用于放射治疗的X射线图像引导系统注册技术审查指导原则 |
含X射线图像引导系统的产品,包括MV级和kV级X射线图像引导、平面和立体成像方式实现的图像引导、集成在放射治疗设备上和治疗室内独立于放射治疗设备的图像引导系统。 |
医疗器械软件注册技术审查指导原则 |
包含软件产品适用 |
医疗器械网络安全注册技术审查指导原则 |
涉及网络安全产品适用 |
医疗器械产品技术要求编写指导原则 |
所有产品适用 |
附录2:标准适用情况
GB 9706.1-2007 医用电气设备第一部分:安全通用要求 |
所有产品适用 |
GB 9706.3-1997医用电气设备第二部分:医用诊断X射线源组件和X射线管组件安全专用要求 |
采用X射线成像图像引导系统的产品适用 |
GB 9706.5-2008医用电气设备能量为1~50MeV医用电子加速器专用安全要求 |
所有产品适用 |
GB 9706.11-1997医用电气设备第二部分:医用诊断X射线源组件和X射线管组件安全专用要求 |
采用X射线成像图像引导系统的产品适用 |
GB 9706.12-1997医用电气设备第一部分:安全通用要求三.并列标准诊断X射线设备辐射防护通用要求 |
采用X射线成像图像引导系统的产品适用 |
GB 9706.14-1997X射线设备附属设备安全专用要求 |
采用X射线成像图像引导系统的产品适用 |
YY 0505-2012 医用电气设备第1—2部分安全通用要求并列标准电磁兼容要求和试验 |
所有产品适用 |
GB 9706.15-2008 医用电气设备第一部分:安全通用要求 1.并列标准:医用电气系统安全要求 |
医用电气系统适用 |
GB 9706.18-2006医用电气设备第2部分 X射线计算机体层摄影设备安全专用要求 |
含CT的产品适用,含CBCT的产品可参照 |
GB 15213-2016医用电子加速器性能和试验方法 |
所有产品适用 |
GB 7247.1-2012激光产品的安全第1部分:设备分类、要求和用户指南 |
含激光定位的产品适用 |
YY 0637-2013 医用电气设备放射治疗计划系统的安全要求 |
含治疗计划系统的产品适用 |
YY 0721-2009 医用电气设备放射治疗记录与验证系统的安全 |
含治疗记录与验证系统的产品适用 |
YY 0775-2010 远距离放射治疗计划系统高能X(γ)射束剂量计算准确性要求和试验方法 |
含远距离放射治疗计划系统的产品适用 |
YY/T 0106-2008 医用诊断X射线机通用技术条件 |
含X射线成像图像引导系统的产品可参照 |
YY/T 0888-2013 放射治疗设备中X射线图像引导装置的成像剂量 |
含X射线成像图像引导系统的产品适用 |
YY/T 0889-2013 调强放射治疗计划系统性能和试验方法 |
含调强放射治疗计划的产品适用 |
YY/T 0890-2013 放射治疗中电子射野成像装置性能和试验方法 |
含电子射野成像装置的产品适用 |
YY/T 0741-2018数字化摄影X射线机专用技术条件 |
含数字X射线图像引导系统的产品可参照 |
YY 0832.1-2011X辐射放射治疗立体定向及计划系统第2部分:头部X辐射放射治疗立体定向及计划系统 |
适用范围包含头部X射线立体定向放射治疗功能的产品适用。 |
YY 0832.2-2015X辐射放射治疗立体定向及计划系统第2部分:体部X辐射放射治疗立体定向及计划系统 |
适用范围包含体部X射线立体定向放射治疗功能的产品适用。 |
YY 1650-2019 X射线图像引导放射治疗设备性能和试验方法 |
含X射线图像引导系统的产品适用。 |
YY/T 1694-2020 放射治疗用体表光学摆位设备性能和试验方法 |
含体表光学摆位系统的产品适用。 |
GB/T 16886系列标准 |
预期直接、间接接触人体产品适用 |
附录3:安全有效基本要求清单
条款号 |
要求 |
适用性 |
A |
通用原则 |
|
A1 |
医疗器械的设计和生产应确保其在预期条件和用途下,由具有相应技术知识、经验、教育背景、培训经历、医疗和硬件条件的预期使用者(若适用),按照预期使用方式使用,不会损害医疗环境、患者安全、使用者及他人的安全和健康;使用时潜在风险与患者受益相比较可以接受,并具有高水平的健康和安全保护方法。 |
适用 |
A2 |
医疗器械的设计和生产应遵循安全原则并兼顾现有技术能力,应当采用以下原则,确保每一危害的剩余风险是可接受的: (1)识别已知或可预期的危害并且评估预期使用和可预期的不当使用下的风险。 (2)设计和生产中尽可能地消除风险。 (3)采用充分防护如报警等措施尽可能地减少剩余风险。 (4)告知剩余风险。 |
适用 |
A3 |
医疗器械在规定使用条件下应当达到其预期性能,满足适用范围要求。 |
适用 |
A4 |
在生命周期内,正常使用和维护情况下,医疗器械的特性和性能的退化程度不会影响其安全性。 |
适用 |
A5 |
医疗器械的设计、生产和包装应当能够保证其说明书规定的运输、贮存条件(如温度和湿度变化),不对产品特性及性能造成不利影响。 |
适用 |
A6 |
所有风险以及非预期影响应最小化并可接受,保证在正常使用中受益大于风险。 |
适用 |
B |
医疗器械安全性能基本原则 |
|
B1 |
化学、物理和生物学性质 |
|
B1.1 |
材料应当能够保证医疗器械符合A节提出的要求,特别注意: (1) 材料的选择应特别考虑毒性、易燃性(若适用)。 (2) 依据适用范围,考虑材料与生物组织、细胞、体液的相容性。 (3)材料的选择应考虑硬度,耐磨性和疲劳强度等属性(若适用)。 |
适用 |
B1.2 |
医疗器械的设计、生产和包装应尽可能减少污染物和残留物对从事运输、贮存、使用的人员和患者造成的风险,特别要注意与人体暴露组织接触的时间和频次。 |
适用 |
B1.3 |
医疗器械的设计和生产,应当能够保证产品在正常使用中接触到其他的材料、物质和气体时,仍然能够安全使用。如果医疗器械用于给药,则该产品的设计和生产需要符合药品管理的有关规定,且正常使用不改变其产品性能。 |
适用 |
B1.4 |
医疗器械的设计和生产应当尽可能减少滤出物或泄漏物造成的风险,特别注意其致癌、致畸和生殖毒性。 |
适用 |
B1.5 |
医疗器械的设计和生产应当考虑在预期使用条件下,产品及其使用环境的特性,尽可能减少物质意外从该产品进出所造成的风险。 |
适用 |
B2 |
感染和微生物污染 |
|
B2.1 |
医疗器械的设计和生产应当减少患者、使用者及他人感染的风险。设计应当: (1)易于操作。 (2)尽可能减少来自产品的微生物泄漏和/或使用中微生物暴露。 (3)防止人对医疗器械和样品的微生物污染。 |
不适用 |
B2.2 |
标有微生物要求的医疗器械,应当确保在使用前符合微生物要求。 |
不适用 |
B2.3 |
无菌医疗器械应当确保在使用前符合无菌要求。 |
不适用 |
B2.4 |
无菌或标有微生物要求的医疗器械应当采用已验证的方法对其进行加工、制造或灭菌。 |
不适用 |
B2.5 |
无菌医疗器械应当在相应控制状态下(如相应净化级别的环境)生产。 |
不适用 |
B2.6 |
非无菌医疗器械的包装应当保持产品的完整性和洁净度。使用前需要灭菌的产品,其包装应当尽可能减少产品受到微生物污染的风险,且应当适合相应的灭菌方法。 |
不适用 |
B2.7 |
若医疗器械可以以无菌与非无菌两种状态上市,则产品的包装或标签应当加以区别。 |
不适用 |
B3 |
药械组合产品 |
|
B3.1 |
应对该药品和药械组合产品安全、质量和性能予以验证。 |
不适用 |
B4 |
生物源性医疗器械 |
|
B4.1 |
含有动物源性的组织、细胞和其他物质的医疗器械,该动物源性组织、细胞和物质应当符合相关法规规定,且符合其适用范围要求。动物的来源资料应当妥善保存备查。动物的组织、细胞和其他物质的加工、保存、检测和处理等过程应当提供患者、使用者和他人(如适用)最佳的安全保护。特别是病毒和其他传染原,应当采用经验证的清除或灭活方法处理。 |
不适用 |
B4.2 |
含有人体组织、细胞和其他物质的医疗器械,应当选择适当的来源、捐赠者,以减少感染的风险。人体组织、细胞和其他物质的加工、保存、检测和处理等过程应当提供患者、使用者和他人(如适用)最佳的安全保护。特别是病毒和其他传染原,应当采用经验证的清除或灭活方法处理。 |
不适用 |
B4.3 |
含有微生物的细胞和其他物质的医疗器械,细胞及其他物质的加工、保存、检测和处理等过程应当提供患者、使用者和他人(如适用)最佳的安全保护。特别是病毒和其他传染原,应当采用经验证的清除或灭活方法处理。 |
不适用 |
B5 |
环境特性 |
|
B5.1 |
如医疗器械预期与其他医疗器械或设备联合使用,应当保证联合使用后的系统整体的安全性,并且不削弱各器械或设备的性能。任何联合使用上的限制应在标签和(或)说明书中载明。液体、气体传输或机械耦合等连接系统,如,应从设计和结构上尽可能减少错误连接造成对使用者的安全风险。 |
适用 |
B5.2 B5.2.1 |
医疗器械的设计和生产应尽可能的消除和减少下列风险: 因物理或者人机功效原因,对患者、使用者或他人造成伤害的风险。 |
适用 |
B5.2.2 |
由人机功效、人为因素和使用环境所引起的错误操作的风险。 |
适用 |
B5.2.3 |
与合理可预见的外部因素或环境条件有关的风险,比如磁场、外部电磁效应、静电放电、诊断和治疗带来的辐射、压力、湿度、温度以及压力和加速度的变化。 |
适用 |
B5.2.4 |
正常使用时可能与材料、液体和气体接触而产生的风险。 |
不适用 |
B5.2.5 |
软件及其运行环境的兼容性造成的风险。 |
适用 |
B5.2.6 |
物质意外进入的风险。 |
适用 |
B5.2.7 |
临床使用中与其他医疗器械共同使用的产品,其相互干扰的风险。 |
适用 |
B5.2.8 |
不能维护或校准(如植入产品)的医疗器械因材料老化、测量或控制精度减少引起的风险。 |
适用 |
B5.3 |
医疗器械的设计和生产应尽可能地减少在正常使用及单一故障状态下燃烧和爆炸的风险。尤其是在预期使用时,暴露于可燃物、致燃物或与可燃物、致燃物联合使用的医疗器械。 |
适用 |
B5.4 |
须进行调整、校准和维护的医疗器械的设计和生产应保证其相应过程安全进行。 |
适用 |
B5.5 |
医疗器械的设计和生产应有利于废物的安全处置。 |
适用 |
B6 |
有诊断或测量功能的医疗器械产品 |
|
B6.1 |
有诊断或测量功能的医疗器械,其设计和生产应充分考虑其准确度、精密度和稳定性。准确度应规定其限值。 |
适用 |
B6.2 |
任何测量、监视或显示的数值范围的设计,均应当符合人机工效原则。 |
适用 |
B6.3 |
所表达的计量值应是中国通用的标准化单位,并能被使用者理解。 |
适用 |
B7 |
辐射防护 |
|
B7.1 |
一般要求:医疗器械的设计、生产和包装应当考虑尽量减少患者、使用者和他人在辐射中的暴露,同时不影响其功能。 |
适用 |
B7.2 |
预期的辐射:应用放射辐射进行治疗和诊断的医疗器械,放射剂量应可控。其设计和生产应当保证相关的可调参数的重复性及误差在允许范围内。若医疗器械预期辐射可能有危害,应当具有相应的声光报警功能。 |
适用 |
B7.3 |
非预期的辐射:医疗器械的设计和生产应当尽可能减少患者、使用者和他人暴露于非预期、杂散或散射辐射的风险。 |
适用 |
B7.4 |
电离辐射:预期放射电离辐射的医疗器械,其设计和生产应当保证辐射放射的剂量、几何分布和能量分布(或质量)可控。 放射电离辐射的医疗器械(预期用于放射学诊断),其设计和生产应当确保产品在实现其临床需要的影像品质的同时,使患者和使用者受到的辐射吸收剂量降至最低。应当能够对射线束的剂量、线束类型、能量和能量分布(适用时)进行可靠的监视和控制。 |
适用 |
B8 |
含软件的医疗器械和独立医疗器械软件 |
|
B8.1 |
含软件的医疗器械或独立医疗器械软件,其设计应当保证重复性、可靠性和性能。当发生单一故障时,应当采取适当的措施,尽可能地消除和减少风险。 |
适用 |
B8.2 |
对于含软件的医疗器械或独立医疗器械软件,其软件必须根据最新的技术水平进行确认(需要考虑研发周期、风险管理要求、验证和确认要求)。 |
适用 |
B9 |
有源医疗器械和与其连接的器械 |
|
B9.1 |
对于有源医疗器械,当发生单一故障时,应当采取适当的措施,尽可能的消除和减少因此而产生的风险。 |
适用 |
B9.2 |
患者安全需要通过内部电源供电的医疗器械保证的,医疗器械应当具有检测供电状态的功能。 |
根据产品情况确定 |
B9.3 |
患者安全需要通过外部电源供电的医疗器械保证的,医疗器械应当包括显示电源故障的报警系统。 |
根据产品情况确定 |
B9.4 |
预期用于监视患者一个或多个临床参数的医疗器械,应当配备适当的报警系统,在患者生命健康严重恶化或生命危急时,进行警告。 |
不适用 |
B9.5 |
医疗器械的设计和生产,应当具有减少产生电磁干扰的方法。 |
适用 |
B9.6 |
医疗器械的设计和生产,应当确保产品具备足够的抗电磁骚扰能力,以保证产品能按照预期运行。 |
适用 |
B9.7 |
医疗器械的设计和生产,应当保证产品在按要求进行安装和维护后,在正常使用和单一故障时,患者、使用者和他人免于遭受意外电击。 |
适用 |
B10 |
机械风险的防护 |
|
B10.1 |
医疗器械的设计和生产,应当保护患者和使用者免于承受因移动时遇到阻力、不稳定部件和运动部件等产生的机械风险。 |
适用 |
B10.2 |
除非振动是医疗器械的特定性能要求,否则医疗器械的设计和生产应将产品振动导致的风险降到最低。若可行,应当采用限制振动(特别是针对振动源)的方法。 |
适用 |
B10.3 |
除非噪声是医疗器械的特定性能要求,否则医疗器械设计和生产应将产品噪声导致的风险降到最低。若可行,应当采用限制噪声(特别是针对噪声源)的方法。 |
适用 |
B10.4 |
需要用户操作的连接电、气体或提供液压和气压的端子和连接器,其设计和构造应当尽可能降低操作风险。 |
适用 |
B10.5 |
如果医疗器械的某些部分在使用前或使用中需要进行连接或重新连接,则其设计和生产应将连接错误的风险降到最低。 |
适用 |
B10.6 |
可触及的医疗器械部件(不包括预期提供热量或达到给定温度的部件和区域)及其周围,在正常使用时,不应达到造成危险的温度。 |
适用 |
B11 |
提供患者能量或物质而产生风险的防护 |
|
B11.1 |
用于给患者提供能量或物质的医疗器械,其设计和结构应能精确地设定和维持输出量,以保证患者和使用者的安全。 |
适用 |
B11.2 |
若输出量不足可能导致危险,医疗器械应当具有防止和/或指示“输出量不足”的功能。应有适当的预防方式,以防止意外输出达危险等级的能量或物质。 |
不适用 |
B11.3 |
医疗器械应清楚地标识控制器和指示器的功能。若器械的操作用显示系统指示使用说明、运行状态或调整参数,此类信息应当易于理解。 |
适用 |
B12 |
对非专业用户使用风险的防护 |
|
B12.1 |
医疗器械的设计和生产应当考虑非专业用户所掌握的知识、技术和使用的环境,应当提供足够的说明,便于理解和使用。 |
不适用 |
B12.2 |
医疗器械的设计和生产应当尽可能减少非专业用户操作错误和理解错误所致的风险。 |
不适用 |
B12.3 |
医疗器械应当尽可能设置可供非专业用户在使用过程中检查产品是否正常运行的程序。 |
不适用 |
B13 |
标签和说明书 |
|
B13.1 |
考虑到使用者所受的培训和所具备的知识,标签和说明书应能让使用者获得充分的信息,以辨别生产企业,安全使用产品实现其预期功能。信息应当易于理解。 |
适用 |
B14 |
临床评价 |
|
B14.1 |
应当依照现行法规的规定提供医疗器械临床评价资料。 |
适用 |
B14.2 |
临床试验应当符合《赫尔辛基宣言》。临床试验审批应当依照现行法规的规定。 |
进行临床试验的情形适用 |
本审评要点旨在指导注册申请人对腹腔内窥镜手术系统产品注册申报资料的准备及撰写,同时也为技术审评部门审评注册申报资料提供参考。
本审评要点是对腹腔内窥镜手术系统产品的一般要求,注册申请人应依据产品的具体特性确定其中内容是否适用,若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容进行充实和细化。
一、产品范围
本审评要点适用于腹腔内窥镜手术系统(简称手术系统)产品注册,按现行《医疗器械分类目录》,该类产品分类编码为01-07-03,管理类别为Ⅲ类。
二、产品概况
腹腔内窥镜手术系统:标准配置包括医生控制台、患者手术平台,可选配置包括影像处理平台、三维腹腔内窥镜(简称内窥镜)、手术器械等。
(一)医生控制台
外科医生坐在医生控制台,通过使用手动控制器(主控制器)和一组脚踏板来控制手术器械和内窥镜(如有)的所有运动。三维内窥镜用于采集手术区域的立体图像,外科医生在3D观察器(图1)或者佩戴3D眼镜在显示屏(图2)上通过观察患者解剖和手术器械的视图及其他用户界面特征。本文图示仅为示例,实际不同厂家结构设计有所不同。

图1 医生控制台(3D观察器)
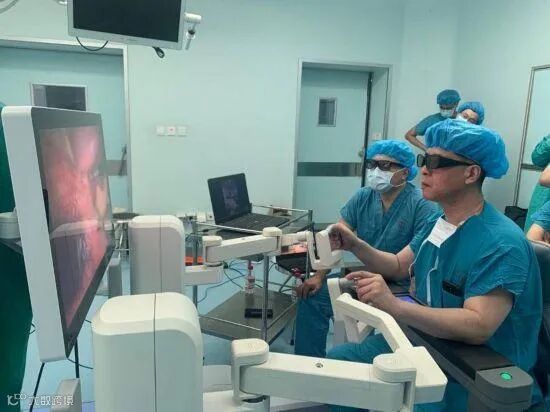
图2 医生控制台(佩戴3D眼镜观察)
医生控制台最主要的控制部件为手动控制器,如图3所示。手动控制器用以捕捉外科医生的手部或者手臂动作,例如手动控制器平移6cm,终端器械移动的距离为2cm,该比例可根据实际手术情况进行调节。

图3手动控制器
(二)患者手术平台
患者手术平台位于手术床旁,包含四个机械臂。内窥镜(如有)可连接到其中一个机械臂上,用于提供患者解剖结构的3D视图。手术精细操作则由医生通过医生控制台进行控制。
1.激光定位
患者手术平台可具有激光指示灯,为用户提供定位信息。手术前首先进行水平定位和手术定位,使手术平台和机械臂处于一个合适的手术位置。
2.吊杆
吊杆是可调节的旋转支撑结构,可以将机械臂移动到适合于执行手术的位置。
3.立柱
可向上或向下移动吊杆以调整平台的高度。
4. 机械臂
四个机械臂的作用是实现握持并移动或操控内窥镜(如有)和手术器械。机械臂通过器械中五个对应的转轮对器械进行控制。每个转轮负责控制不同的器械动作,比如有的控制绕轴线自转、有的控制开合等。根据产品设计不同,机械臂也可能为两个或者三个。不同厂家机械臂的结构和各部分的叫法可能有所差异,但基本原理和功能类似。

图4患者手术平台
(三)影像处理平台(如有)
影像处理平台包括系统核心设备、内窥镜控制器和视频处理器。影像处理平台还可具有触摸屏以观看内窥镜图像并调整系统设置。内窥镜控制器用于为内窥镜提供控制和照明,视频处理器用于从内窥镜控制器获取左右视频输入信号,并将处理后的图像输出提供给核心设备,系统核心设备功能包括:
1.与医生控制台及患者手术平台进行通信。将来自各种源(例如视频处理器、外部输入)的视频信号分发到各种终端(例如触摸屏、外部输出);
2.与第三方高频发生器通信,从医生控制台脚踏板启用电能量实现电凝、电灼、电切等切割、分离、止血等操作。
影像处理平台组成如图5所示。
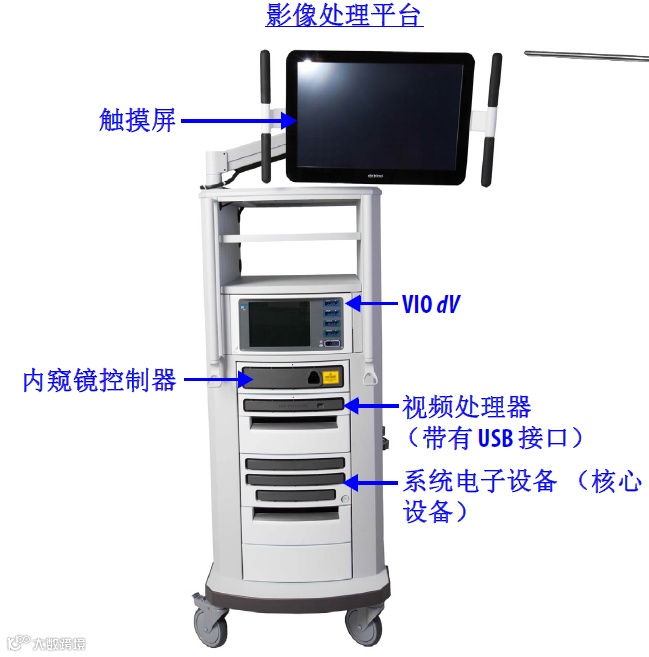
图5影像处理平台
手术系统如使用通用的三维腹腔内窥镜(非手术系统专用)提供影像,产品组成可不包括影像处理平台。通常手术系统与通用内窥镜以及内窥镜设备之间不进行通讯,机械臂也不夹持或者控制内窥镜的运动。
以上是典型的腹腔内窥镜手术系统的工作原理,描述仅为举例,注册申报资料按产品实际情况描述,产品组成可在上述基础上有所删减,例如不包括内窥镜以及影像处理平台,不包含激光定位装置等。
腹腔内窥镜手术系统核心的工作原理是“主从遥操作”,即操作者操控医生控制台上的主控制器,经传感器测量、主从映射变化、从手逆运动学等机器人学原理,计算从手各关键的位置和速度,以实现对主手运动的精确复制,从而精确控制患者手术平台上的手术器械并完成手术。
三、基本要求
(一)产品名称
产品组成中如包含手术器械,产品名称可命名为“腹腔内窥镜手术系统”;产品组成中如不包含手术器械,仅包括医生控制台、患者手术平台和影像处理平台基本配置,产品名称可命名为“腹腔内窥镜手术器械控制系统”。如手术系统不属于GB9706.15中定义的“医用电气系统”范畴,则产品名称命名为“腹腔内窥镜手术设备”或“腹腔内窥镜手术器械控制系统”。
(二)注册单元
通常与手术系统存在物理连接或者电气连接的专用的部件或者附件可以与手术系统作为同一注册单元,例如通过机械臂控制的内窥镜和手术器械均可与手术系统作为一个注册单元。
与手术系统不存在物理连接或者电气连接的部件或附件不与该手术系统作为一个注册单元,例如传统的穿刺用器械或其他不通过机械臂控制的手术器械或附件。对于在临床中共同使用,与手术系统连接的通用设备、能量平台,则不与该系统作为同一个注册单元,例如内窥镜冷光源、高频手术设备、超声切割止血设备等,与手术系统连接使用的手术器械也可单独注册。
手术过程中覆盖手术系统用的一次性使用无菌保护套不与手术系统作为一个注册单元。
配合使用的通用三维腹腔内窥镜以及其图像处理主机,不与手术系统作为一个注册单元。但如果三维内窥镜和图像处理主机手术系统专用,则可作为一个注册单元,内窥镜冷光源通常不作为一个注册单元。
(三)结构组成
医疗器械申请表产品结构组成一栏可描述为由医生控制台、患者手术平台、影像处理平台(如有)、三维腹腔内窥镜(如有)、手术器械以及附件组成,但同时在申请表附件中以列表的形式明确系统组件中每个组成部分的规格型号和所包含的组成,在综述资料中详述每个组成部分的功能,附件中结构组成描述举例见表1。附件可包括可插拔的线缆、转接头、一次性使用绝缘套等。如含有一次性使用的或无菌提供的产品组成,应明确。产品组成中如包含血管闭合器、超声手术刀头,应在手术器械列表中明确其配合使用的主机,配用的主机应经过验证。
表1 产品结构组成列表示例
组件名称 |
规格型号 |
组成部分 |
医生控制台 |
*** |
包括手动控制器、脚踏面板、3D观察器等。 |
患者手术平台 |
*** |
包括基座、手柄、支柱、吊杆、机械臂等。 |
影像处理平台 |
*** |
包括内窥镜图像处理装置、触摸屏、台车等。 |
三维腹腔内窥镜 |
*** |
包括头端部、插入部、接口部分等 |
以上仅为举例,注册时应根据产品实际情况明确产品组成,不含有“等”字样表述。
对于手术器械,建议在产品技术要求中按无源手术器械和有源手术器械分别列表明确,格式举例见表2。
表2 手术器械列表举例
器械 名称 |
规格型号 |
提供 方式 |
货架寿命/使用次数 |
功能 描述 |
持针钳 |
**** |
非无菌 |
10次 |
用于持针进行缝合。 |
一次性使用血管闭合器 |
*** |
环氧乙烷灭菌 |
3年 |
与***主机配合使用,用于闭合直径不超过**mm血管的。 |
(四)综述资料
按照《关于公布医疗器械注册申报资料要求和批准证明文件格式的公告》(国家药监局2021年第121号)提交申报资料,在综述资料中提供产品组成各部分的清晰的彩色实物图示,包括医生控制台的各细节、患者手术平台的各细节、手术器械头端部、手术连接部、机械臂、按键、接口等,说明各个组成部分的作用以及连接关系,包括脚踏面板上各部分的作用,多个机械臂如有差异的应予以说明。说明各运动部分的自由度并以配以图示。如配合使用的产品已获得注册证或正在进行注册,应提供相应注册证或说明注册进度,例如超声手术刀头配用的超声手术设备主机。对于专用第三方设备,应提供双方的合作协议。
列表比较与参考的同类产品的异同,应包括在主控制臂、运动控制、机械臂结构、手术器械等方面的差异。
四、产品研究
(一)化学和物理性能研究
1.应当提供产品化学/材料表征、物理和/或机械性能指标的确定依据、设计输入来源以及临床意义,所采用的标准或方法、采用的原因及理论基础。提供产品机械臂控制精度的相关技术资料,以及各级传递后的理论累计误差;基于上述因素,确认产品当前所确定的主从控制精度是否合理且可接受。提供运动控制重复性、复现性等验证资料,应考虑各种极限运动状态;提供机械臂运动控制可能出现的末端振动研究。提供机械臂的稳定性和可靠性研究,模拟各种非正常状态(如误操作、外界碰撞等)对设备稳定性的影响,是否会发生不可接受的风险;提供手术器械与组织接触力的研究。
2.联合使用
含有超声刀头、血管闭合器的,应提供其与声称的主机联合使用研究资料。
(二)电气系统安全性研究
应当提供电气安全性、机械和环境保护以及电磁兼容性的研究资料,说明适用的标准以及开展的研究。
(三)辐射安全研究
产品组成中如含有光源,应提供光辐射安全研究资料。如果产品组成中含有激光,例如用于进行术前定位的激光,通常为弱激光,可通过检测GB7247.1-2012标准的符合性评价光辐射安全。如果产品组成中含有非激光,例如内窥镜冷光源,可参考GB/ T 20145-2006 (IEC62471:2006)灯和灯系统的光生物安全性,YY 9706.257-2021医用电气设备第2-57部分:治疗、诊断、监测和整形/医疗美容使用的非激光光源设备基本安全和基本性能的专用要求、IEC/TR 62471-2:2009 Photobiological safety of lamps and lamp systems-Part 2: Guidance on manufacturing requirements relating to non –laser optical radiation safety提交研究资料。如果照明光源为LED光源,需同时考虑YY/T 1534 -2017 医用LED设备光辐射安全分类的检测方法。
(四)软件研究
手术系统软件安全性级别通常为C级。申请人应按照《医疗器械软件注册技术审查指导原则》的相关要求提供资料。如涉及网络安全(例如远程控制),应按照《医疗器械网络安全注册技术审查指导原则》相关要求提供资料。产品若通过电子接口与其他医疗器械或非医疗器械交换并使用信息,应当提供互操作性研究资料,包括基本信息、需求规范、风险管理、验证与确认、维护计划等内容。
(五)生物学特性研究
手术系统中内窥镜、手术器械、3D观察器等与人体直接或间接接触的部分,应进行生物学特性研究。
1.描述产品所用材料及与人体接触性质,设计和生产过程中可能引入的污染物和残留物,设计和生产过程中可能产生的析出物(包括滤沥物和/或蒸发物)、降解产物、加工残留物,与医疗器械直接接触的包装材料等相关信息。
2.描述申报产品的物理和/或化学信息并考虑材料表征(如适用),如器械的物理作用可能产生生物学风险,应当进行评价。
3.生物学评价的策略、依据和方法。
4.已有数据和结果的评价。
5.选择或豁免生物学试验的理由和论证。
6.完成生物学评价所需的其他数据。
如含有多种手术器械且原材料、灭菌方式、加工工艺、预期用途等存在差异的,应对每种手术器械分别开展生物学评价。生物学特性研究应描述每个接触部位所用的材料,以图示进行说明,如涉及开展生物学试验的,通常应考虑开展细胞毒性、致敏、皮内反应试验,可选取典型产品进行试验,并说明评价产品与试验产品之间的差异。如手术器械的成分仅为医用不锈钢,不包含镀层或者金属合金,无加工助剂或者灭菌剂残留的,申请人如提供了材质证明,可豁免生物相容性试验。与已上市产品相比,如内窥镜或手术器械中采用新的材料,申请人应在评价资料中详述其理化性能和生物学特性。如豁免生物学试验,可参考《关于印发医疗器械生物学评价和审查指南的通知》(国食药监械﹝2007﹞345号)中的附件2出具评价报告。
(六)清洁、消毒、灭菌研究
因手术系统中的内窥镜以及手术器械在使用过程中与人体无菌组织接触,使用前均应进行灭菌。申请人应开展清洁、消毒、灭菌研究。
1.生产企业灭菌:应当明确灭菌工艺(方法和参数)和无菌保证水平(SAL),并提供灭菌验证及确认的相关研究资料。
2.使用者灭菌:应当明确推荐的灭菌工艺(方法和参数)、所推荐灭菌工艺的确定依据以及验证的相关研究资料;对可耐受两次或多次灭菌的产品,应当提供产品所推荐灭菌工艺耐受性的研究资料,证明产品按照正常灭菌耐受次数进行清洗、消毒、灭菌和使用后,产品性能功能符合预期要求。申请人进行灭菌确认时应考虑经确认的灭菌程序适用于使用者,包括灭菌工艺、灭菌设备、灭菌包装等。可参考美国FDA指导原则Reprocessing Medical Device in Health Care Settings:Validation Methods and Lableling。
灭菌确认报告应能证明所推荐的灭菌工艺对于申报产品的灭菌效果,所有器械应接受最恶劣的微生物挑战和灭菌挑战,并在灭菌后进行无菌测试。若申请人经过评价认为申报产品适用于其他已确认产品的灭菌程序,可提供相关的评价资料和其他产品的灭菌确认报告,评价资料应对与灭菌有效性相关的特征逐一进行评价,包括生物负载、包装、结构(开口、内表面等)、材料、制作过程等。
3.使用者清洁和消毒:应当明确推荐的清洗和消毒工艺(方法和参数)、工艺的确定依据以及验证的相关研究资料。
4.残留毒性:若产品经灭菌或消毒后可能产生残留物质,应当对灭菌或消毒后的产品进行残留毒性的研究,明确残留物信息及采取的处理方法,并提供相关研究资料。例如EO(环氧乙烷)灭菌应考虑EO、ECH(2-氯乙醇)残留。
5.以非无菌状态交付,且使用前需灭菌的医疗器械,应当提供证明包装能减少产品受到微生物污染的风险,且适用于生产企业规定灭菌方法的研究资料。
(七)动物试验研究
手术系统在临床评价前,通常需开展动物试验。按照《医疗器械临床评价技术指导原则》,手术系统可通过同品种医疗器械临床试验或临床试用获得的数据进行分析评价(简称同品种比对),也可通过临床试验进行临床评价。对于通过同品种比对开展临床评价的(例如对已获准注册的手术系统进行了设计变更),动物试验可作为证明产品安全有效性的支持性资料。对于通过临床试验开展临床评价的,动物试验可作为临床试验前的可行性研究,为医疗器械能否用于人体研究提供支持,降低临床实验受试者及使用者的风险以及为临床试验设计提供参考。在产品设计开发的过程中,也可通过动物试验对产品安全有效性进行确认,动物试验的结果可作为设计更改的输入材料。开展动物试验应考虑以下要素:(1)所选用的动物解剖结构和术式应能模拟其临床应用,申请人应论证选用动物模型及术式的合理性。(2)动物实验的有效性和安全性评价指标应结合术式和临床应用中的关注点确定。
应当提供动物试验研究资料,研究资料应当包括试验目的、实验动物信息、受试器械和对照信息、动物数量、评价指标和试验结果、动物试验设计要素的确定依据等内容。
(八)稳定性研究
1.货架有效期
产品组成中如含有无菌提供的手术机械或附件,例如超声刀头,血管闭合器,应当提供货架有效期和包装研究资料,可通过对产品和包装进行加速老化和/或实时老化试验,试验后对产品进行性能、功能和无菌检测,对包装外观、完整性、密封性进行检测,证明产品在有效期内保持无菌且性能功能符合预期要求。
2.使用稳定性
不同产品影响使用稳定性的因素不同,对于手术系统,需分别规定各个组成部分的有效期并提供相应的研究资料。对于有限次重复使用且使用前需要灭菌的器械,例如内窥镜和手术器械,其使用稳定性主要取决于耐受的灭菌次数,其使用次数研究通常与灭菌耐受性研究合并进行,通过对手术器械模拟多次使用、清洁、消毒灭菌后,对产品性能和安全进行测试,证明产品的性能功能满足使用要求。
对于手术系统中的其他组成部分,例如医生控制台、患者手术平台等,其使用稳定性需要考虑使用的影响、环境的影响等多种因素,可通过可靠性测试进行验证。通过对产品进行老化/疲劳试验,试验后对产品性能、功能和电气安全进行检验,证明器械在声称的有效期内,在正常使用、维护和校准(如适用)情况下,产品的性能功能满足使用要求。设备中如包含可更换的部件或附件,应对更换周期进行研究,同时在说明书和标签中明确产品的使用期限,可更换部件的更换周期、产品保养及维护方法。有效期的试验方法和试验报告可参考《有源医疗器械使用期限注册技术审查指导原则》。
3.运输稳定性
应当提供运输稳定性和包装研究资料,证明在生产企业规定的运输条件下,运输过程中的环境条件(例如:震动、振动、温度和湿度的波动)不会对医疗器械的特性和性能,包括完整性和清洁度,造成不利影响。
运输稳定性通常通过模拟运输试验进行,通过模拟在贮存和运输的过程中,遇到极端情况时,例如环境(温度、湿度、气压等)变化、跌落、碰撞、振动、加速度等,产品不会发生性能、功能改变,包装系统具有保护产品的能力。经过模拟试验后,观察包装外观是否有不可接受的异常现象,测试产品性能功能是否符合要求,证明运输过程中的环境条件不会对医疗器械的特性和性能,包括完整性和清洁度,造成不利影响。环境试验要求和试验方法可参考GB/T 14710-2009 医用电器环境要求及试验方法。
(九)人因设计/可用性研究
手术系统在医疗器械中属于操控相对复杂的器械,且其操控性对于产品的安全有效性至关重要,为高使用风险器械,可用性研究也因此显得尤为重要。可用性是指预期用户在预期使用场景下正常使用医疗器械时,保证医疗器械安全使用的用户接口易用特性。用户接口是指用户与医疗器械人机交互的全部对象及方式,包括医疗器械的形状尺寸、显示反馈、连接组装、操作控制、说明书与标签、包装、用户培训材料等,可用性研究可参考IEC 62366-1:2015 Medical device-Part 1 :application of usability engineering to medical device、IEC TR 62366-2:2016 Medical device-Part 2 :Guidance on the application of engineering to medical device、美国FDA指南Applying Human Factors and Usability Engineering to Medical Devices。通过可用性研究,识别和评估所有与使用相关的风险,确认所有剩余风险是可接受的。我国组织起草的《医疗器械人因设计技术审查指导原则》已完成公开征求意见,相关人员可关注后续发布通知。
可用性测试是指在实验室、模拟使用环境、真实使用环境开展的用户接口测试,包括生产企业的模拟使用测试、可用性实验室的检验测试、真实使用环境的现场测试,也可与已上市同类医疗器械开展可用性对比测试。
五、产品技术要求及检测相关要求
产品技术要求可参考的标准见附件2,格式及内容见附件4。含产品有多个软件的,应列出所有软件的名称、发布版本及命名规则。涉及运动范围的,建议给出运动范围图示。对于三维内窥镜,产品技术要求中应包括左右两路有效光度率偏差、左右两路单位相对畸变偏差、左右两路图像旋转偏差、左右两路中心位置偏差(水平方向和垂直方向)、左右两路放大倍率差、左右两路图像时差(电子镜适用)得要求。
附件1:适用和可参考的指导原则列表
指导原则名称 |
适用情况 |
医疗器械软件注册技术审查指导原则 |
所有产品适用 |
医疗器械网络安全注册技术审查指导原则 |
涉及网络安全产品适用 |
医疗器械注册单元划分指导原则 |
所有产品适用 |
医疗器械产品技术要求编写指导原则 |
所有产品适用 |
有源医疗器械使用期限注册技术审查指导原则 |
所有产品适用 |
医疗器械产品受益-风险评估注册技术审查指导原则 |
创新产品适用 |
医疗器械安全和性能基本原则 |
所有产品适用 |
医疗器械通用名称命名指导原则 |
所有产品适用 |
医疗器械动物试验研究注册审查指导原则第一部分:决策原则(2021年修订版) |
开展动物试验产品适用。 |
医疗器械动物试验研究注册审查指导原则第二部分:试验设计、实施质量保证 |
开展动物试验产品适用 |
医疗器械已知可沥滤物测定方法验证及确认注册技术审查指导原则 |
需要开展已知可沥滤物评价的产品适用 |
腹腔镜手术器械技术审查指导原则 |
手术器械参考引用 |
手术电极产品注册技术指导原则 |
含高频手术电极的产品参考引用 |
超声软组织切割止血系统注册技术审查指导原则 |
含超声刀头的产品参考引用 |
腔镜用吻合器产品注册技术审查指导原则 |
含有吻合器的产品适用 |
FDA指南:Applying Human Factors and Usability Engineering to Medical Devices |
所有产品适用 |
FDA指南:Reprocessing Medical Device in Health Care Settings:Validation Methods and Lableling |
含有可重复使用的手术器械或者内窥镜适用 |
IEC指南:IEC TR 62366-2:2016 Medical device-Part 2 :Guidance on the application of engineering to medical device |
所有产品适用 |
附件2:适用和可参考的标准列表
标准编号及名称 |
适用情况 |
GB 9706.1-2007医用电气设备第1部分:安全通用要求 |
全部产品适用 |
GB 9706.1-2020医用电气设备第1部分:基本安全和基本性能的通用要求 |
GB 9706.1-2020替代了GB 9706.1-2007、GB 9706.15-2008,于2023-05-01实施 |
GB 9706.4-2009医用电气设备第2-2部分:高频手术设备安全专用要求 |
含高频手术器械的产品适用 |
GB 9706.15-2008医用电气设备第1-1部分:安全通用要求并列标准:医用电气系统安全要求 |
医用电气系统类产品适用 |
GB 9706.19-2000医用电气设备第2部分:内窥镜设备安全专用要求 |
含有内窥镜、内窥镜附件适用 |
GB 7247.1-2012激光产品的安全第1部分:设备分类、要求 |
含有激光模块适用 |
GB/T 14710-2009医用电器环境要求及试验方法 |
全部产品适用 |
GB/T 16886生物相容性系列标准 |
含有与人体直接或间接接触部分的适用 |
GB/ T 20145-2006灯和灯系统的光生物安全性 |
含有非激光光源适用 |
YY 9706.257-2021医用电气设备第2-57部分:治疗、诊断、监测和整形/医疗美容使用的非激光光源设备基本安全和基本性能的专用要求 |
含有非激光光源产品适用,2023-05-01起实施。 |
YY 0505-2012医用电气设备第1-2部分:安全通用要求并列标准:电磁兼容要求和试验 |
全部产品适用 |
YY 9706.102-2021 医用电气设备第1-2部分:基本安全和基本性能的通用要求并列标准:电磁兼容要求和试验 |
全部产品适用,2023-05-01起实施。 |
YY 0709-2009医用电气设备第1-8部分:安全通用要求并列标准:通用要求医用电气设备和医用电气系统中报警系统的测试和指南 |
具有报警功能适用 |
YY 9706.108-2021医用电气设备第1-8部分:基本安全和基本性能的通用要求并列标准:通用要求,医用电气设备和医用电气系统中报警系统的测试和指南 |
具有报警功能适用,2023-05-01起实施。 |
YY/T 9706.106-2021 医用电气设备第1-6部分:基本安全和基本性能的通用要求并列标准:可用性 |
所有产品适用,2023-05-01起实施。 |
YY/T 0842-2011医用内窥镜内窥镜附件镜鞘 |
含有镜鞘产品适用 |
YY/T 1587-2018医用内窥镜电子内窥镜 |
含电子内窥镜的产品适用 |
YY 0068系列医用内窥镜硬性内窥镜 |
含硬性内窥镜的产品适用 |
YY 1057-2016医用脚踏开关通用技术条件 |
含脚踏开关的产品适用 |
YY/T 1750-2020超声软组织切割止血手术设备 |
含有超声刀头产品适用,2022年9月1日实施。 |
YY 0876-2013直线型切割吻合器及组件 |
含吻合器的产品适用 |
YY/T 0686-2017医用镊 |
含镊类器械的产品适用 |
YY/T 0940-2014医用内窥镜内窥镜器械抓取钳 |
含抓取钳器械的产品适用 |
YY/T 0941-2014医用内窥镜内窥镜器械咬切钳 |
含咬切钳器械的产品适用 |
YY/T 0943-2014医用内窥镜内窥镜器械持针钳 |
含持针钳器械的产品适用 |
YY/T 0944-2014医用内窥镜内窥镜器械分离钳 |
含分离钳器械的产品适用 |
YY 0672.2-2011内镜器械第2部分腹腔镜用剪 |
含剪类器械的产品适用 |
YY/T 1534 -2017 医用LED设备光辐射安全分类的检测方法 |
含LED光源适用 |
YY/T 1686-2020采用机器人技术的医用电气设备分类 |
全部产品适用 |
YY/T 1712-2021采用机器人技术的辅助手术设备和辅助手术系统 |
全部产品适用,2022-10-01起实施 |
YY/T 1603-2018医用内窥镜内窥镜功能供给装置摄像系统 |
含图像处理主机的产品适用 |
IEC 80601-2-77:2019 Medical electrical equipment - Part 2-77: Particular requirements for the basic safety and essential performance of robotically assisted surgical equipment |
所有产品适用 |
IEC 62366-1:2015 Medical device-Part 1 :application of usability engineering to medical device |
所有产品适用 |
ISO 13850-2015 Safety of machinery - Emergency stop function - Principles for design |
含有急停装置适用 |
附件3:《医疗器械安全和性能基本原则》各项内容的适用性
要 求 |
适用性 |
2.1概述 |
|
2.1.1医疗器械应实现注册人/备案人的预期性能,其设计和生产应确保器械在预期使用条件下达到预期目的。这些器械应是安全的并且能够实现其预期性能,与患者受益相比,其风险应是可接受的,且不会损害医疗环境、患者安全、使用者及他人的安全和健康。 |
适用 |
2.1.2注册人/备案人应建立、实施、形成文件和维护风险管理体系,确保医疗器械安全、有效且质量可控。在医疗器械全生命周期内,风险管理是一个持续、反复的过程,需要定期进行系统性的改进更新。在开展风险管理时,注册人/备案人应:建立涵盖所有医疗器械风险管理计划并形成文件;识别并分析涵盖所有医疗器械的相关的已知和可预见的危险(源);估计和评价在预期使用和可合理预见的误使用过程中,发生的相关风险;依据2.1.3和2.1.4相关要求,消除或控制c)点所述的风险;评价生产和生产后阶段信息对综合风险、风险受益判定和风险可接受性的影响。上述评价应包括先前未识别的危险(源)或危险情况,由危险情况导致的一个或多个风险对可接受性的影响,以及对先进技术水平的改变等。基于对e)点所述信息影响的评价,必要时修改控制措施以符合2.1.3和2.1.4相关要求。 |
适用 |
2.1.3医疗器械的注册人/备案人在设计和生产过程中采取的风险控制措施,应遵循安全原则,采用先进技术。需要降低风险时,注册人/备案人应控制风险,确保每个危险(源)相关的剩余风险和总体剩余风险是可接受的。在选择最合适的解决方案时,注册人/备案人应按以下优先顺序进行:通过安全设计和生产消除或适当降低风险;适用时,对无法消除的风险采取充分的防护措施,包括必要的警报;提供安全信息(警告/预防措施/禁忌证),适当时,向使用者提供培训。 |
适用 |
2.1.4注册人/备案人应告知使用者所有相关的剩余风险。 |
适用 |
2.1.5在消除或降低与使用有关的风险时,注册人/备案人应该: 适当降低医疗器械的特性(如人体工程学/可用性)和预期使用环境(如灰尘和湿度)可能带来的风险;考虑预期使用者的技术知识、经验、教育背景、培训、身体状况(如适用)以及使用环境。 |
适用 |
2.1.6在注册人/备案人规定的生命周期内,在正常使用、维护和校准(如适用)情况下,外力不应对医疗器械的特性和性能造成不利影响,以致损害患者、使用者及他人的健康和安全。 |
适用 |
2.1.7医疗器械的设计、生产和包装,包括注册人/备案人所提供的说明和信息,应确保在按照预期用途使用时,运输和贮存条件(例如:震动、振动、温度和湿度的波动)不会对医疗器械的特性和性能,包括完整性和清洁度,造成不利影响。注册人/备案人应能确保有效期内医疗器械的性能、安全和无菌保证水平。 |
适用 |
2.1.8在货架有效期内、开封后的使用期间(对于体外诊断试剂,包括在机(机载)稳定性),以及运输或送货期间(对于体外诊断试剂,包括样品),医疗器械应具有可接受的稳定性。 |
适用 |
2.1.9在正常使用条件下,基于当前先进技术水平,比较医疗器械性能带来的受益,所有已知的、可预见的风险以及任何不良副作用应最小化且可接受。 |
适用 |
2.2临床评价 |
|
2.2.1基于监管要求,医疗器械可能需要进行临床评价(如适用)。所谓临床评价,就是对临床数据进行评估,确定医疗器械具有可接受的风险受益比,包括以下几种形式: 临床试验报告(体外诊断试剂临床性能评价报告) 临床文献资料 临床经验数据 |
适用 |
2.2.2临床试验的实施应符合《赫尔辛基宣言》的伦理原则。 保护受试者的权利、安全和健康,作为最重要的考虑因素,其重要性超过科学和社会效益。在临床试验的每个步骤,都应理解、遵守和使用上述原则。另外,临床试验方案审批、患者知情同意、体外诊断试剂剩余样本使用等应符合相关法规要求。 |
适用 |
2.3化学、物理和生物学特性 |
|
2.3.1关于医疗器械的化学、物理和生物学特性,应特别注意以下几点:所用材料和组成成分的选择,需特别考虑:-毒性;-生物相容性;-易燃性;工艺对材料性能的影响;生物物理学或者建模研究结果应事先进行验证(如适用);所用材料的机械性能,如适用,应考虑强度、延展性、断裂强度、耐磨性和抗疲劳性等属性;表面特性;器械与已规定化学和/或物理性能的符合性。 |
适用 |
2.3.2基于医疗器械的预期用途,医疗器械的设计、生产和包装,应尽可能减少污染物和残留物对使用者和患者,以及对从事医疗器械运输、贮存及其他相关人员造成的风险。特别要注意与使用者和患者暴露组织接触的时间和频次。 |
适用 |
2.3.3医疗器械的设计和生产应适当降低析出物(包括滤沥物和/或蒸发物)、降解产物、加工残留物等造成的风险。应特别注意致癌、致突变或有生殖毒性的泄漏物或滤沥物。 |
适用 |
2.3.4医疗器械的设计和生产应考虑到医疗器械及其预期使用环境的性质,适当降低物质意外进入器械所带来的风险。 |
适用 |
2.3.5医疗器械及其生产工艺的设计应能消除或适当降低对使用者和其他可能接触者的感染风险。设计应:操作安全,易于处理;尽量减少医疗器械的微生物泄漏和/或使用过程中的感染风险;防止医疗器械或其内容物(例如:标本)的微生物污染;尽量减少意外风险(例如:割伤和刺伤(如针刺伤)、意外物质溅入眼睛等)。 |
适用 |
2.4灭菌和微生物污染 |
|
2.4.1医疗器械其设计应方便使用者对其进行安全清洁、消毒、灭菌和/或重复灭菌(必要时)。 |
适用 |
2.4.2具有微生物限度要求的医疗器械,其设计、生产和包装应确保在出厂后,按照注册人/备案人规定的条件运输和贮存,符合微生物限度要求。 |
不适用 |
2.4.3以无菌状态交付的医疗器械,其设计、生产和包装应按照适当的程序进行,以确保在出厂时无菌。在注册人/备案人规定的条件下运输和贮存的未破损无菌包装,打开前都应保持无菌状态。应确保最终使用者可清晰地辨识包装的完整性(例如:防篡改包装)。 |
含无菌产品适用 |
2.4.4无菌医疗器械应按照经验证的方法进行加工、生产、包装和灭菌,其货架有效期应按照经验证的方法确定。 |
含无菌产品适用 |
2.4.5预期无菌使用的医疗器械(注册人/备案人灭菌或使用者灭菌),均应在适当且受控的条件和设施下生产和包装。 |
适用 |
2.4.6以非无菌状态交付,且使用前灭菌的医疗器械: 包装应当尽量减少产品受到微生物污染的风险,且应适用于注册人/备案人规定的灭菌方法;注册人/备案人规定的灭菌方法应经过验证。 |
适用 |
2.4.7若医疗器械可以无菌和非无菌状态交付使用,应明确标识其交付状态。 |
不适用 |
2.5环境和使用条件 |
|
2.5.1如医疗器械预期与其他医疗器械或设备整合使用,应确保整合使用后的系统,包括连接系统,整体的安全性,且不影响器械本身的性能。整合使用上的限制应明确标识和/或在使用说明书中明确。对于需要使用者处理的连接,如液体、气体传输、电耦合或机械耦合等,在设计和生产过程中尽可能消除或降低所有可能的风险,包括错误连接或安全危害。 |
适用 |
2.5.2医疗器械的设计和生产应考虑预期的使用环境和使用条件,以消除或降低下列风险: 与物理和人体工程学/可用性的特性有关,对使用者或他人造成损伤的风险;由于用户界面设计、人体工程学/可用性的特性以及预期使用环境导致的错误操作的风险;与合理可预期的外部因素或环境条件有关的风险,如磁场、外部电磁效应、静电释放、诊断和治疗带来的辐射、压力、湿度、温度和/或压力和加速度的变化;正常使用条件下与固体材料、液体和其他物质,包括气体,接触而产生的风险;软件与信息技术(IT)运行环境的兼容性造成的风险;正常使用过程中,医疗器械非预期析出物导致的环境风险;样本/样品/数据不正确识别和错误结果导致的风险,比如用于分析、测试或检测的样本容器、可拆卸部件和/或附件,其颜色和/或数字编码混淆;与其他用于诊断、监测或治疗的医疗器械互相干扰导致的风险。 |
适用 |
2.5.3医疗器械的设计和生产应消除或降低在正常状态及单一故障状态下燃烧和爆炸的风险,尤其是预期用途包括暴露于易燃、易爆物质或其他可致燃物相关的器械联用。 |
不适用 |
2.5.4医疗器械的设计和生产应能确保调整、校准和维护过程能够安全有效的完成。对无法进行维护的医疗器械,如植入物,应尽量降低材料老化等风险;对无法进行调整和校准的医疗器械,如某些类型的温度计,应尽量降低测量或控制机制精度的损失风险。 |
适用 |
2.5.5与其他医疗器械或产品联合使用的医疗器械,其设计和生产应能保证互操作性和兼容性可靠且安全。 |
适用 |
2.5.6医疗器械的设计和生产应能降低未经授权的访问风险, 这种访问可能会妨碍器械正常运行,或造成安全隐患。 |
适用 |
2.5.7具有测量、监视或有数值显示功能的医疗器械,其设计和生产应符合人体工程学/可用性原则,并应顾及器械预期用途、预期使用者、使用环境。 |
不适用 |
2.5.8医疗器械的设计和生产应便于使用者、患者或其他人员对其以及相关废弃物的安全处置或再利用。使用说明书应明确安全处置或回收的程序和方法。 |
适用 |
2.6对电气、机械和热风险的防护 |
|
2.6.1医疗器械的设计和生产应具有机械相关的防护,保护使用者免于承受由诸如运动阻力、不稳定性和活动部件等引起的机械风险。 |
适用 |
2.6.2除非振动是器械特定性能的一部分,否则医疗器械的设计和生产应将产品振动导致的风险降到最低,应尽量采用限制振动(特别是振动源)的方法。 |
适用 |
2.6.3除非噪声是器械特定性能的一部分,否则医疗器械设计和生产应将产品噪声导致的风险降到最低,应尽量采用限制噪声(特别是噪声源)的方法。 |
适用 |
2.6.4如果医疗器械的部件在使用前或使用中需要进行连接或重新连接,其设计和生产应降低这些部件间的连接故障风险。 |
适用 |
2.6.5医疗器械的可接触部件(不包括用于供热或既定温度设置部位)及其周围环境,在正常使用时不应存在过热风险。 |
适用 |
2.7有源医疗器械及与其连接的医疗器械 |
|
2.7.1当有源医疗器械发生单一故障时,应采取适当的措施消除或降低因此而产生的风险。 |
适用 |
2.7.2患者的安全依赖于内部电源供电的医疗器械,应具有检测供电状态的功能,并在电源容量不足时提供适当的提示或警告。 |
不适用 |
2.7.3患者的安全取决于外部电源供电状态的医疗器械,应包括可显示任何电源故障的报警系统。 |
不适用 |
2.7.4用于监视患者一个或多个临床指标的医疗器械,必须配备适当报警系统,在患者健康状况恶化或危及生命时,向使用者发出警报。 |
不适用 |
2.7.5鉴于电磁干扰可能会损害正常运行的装置或设备,医疗器械的设计和生产应降低产生电磁干扰的风险。 |
适用 |
2.7.6医疗器械的设计和生产,应确保产品具有足够的抗电磁干扰能力,以确保产品的正常运行。 |
适用 |
2.7.7当产品按注册人/备案人的说明进行安装和维护,在正常状态和单一故障状态时,医疗器械的设计和生产应减少使用者和他人免于遭受意外电击的风险。 |
适用 |
2.8含有软件的医疗器械以及独立软件 |
|
2.8.1含有电子可编程系统(内含软件组件)的医疗器械或独立软件的设计,应确保准确度、可靠性、精确度、安全和性能符合其预期用途。应采取适当措施,消除或减少单一故障导致的风险或性能降低。 |
适用 |
2.8.2含有软件组件的医疗器械或独立软件,应根据先进技术进行开发、生产和维护,同时应考虑开发生存周期(如快速迭代开发、频繁更新、更新的累积效应)、风险管理(如系统、环境和数据的变化)等原则,包括信息安全(如安全地进行更新)、验证和确认(如更新管理过程)的要求。 |
适用 |
2.8.3预期与移动计算平台整合使用的软件,其设计和开发, 应考虑平台本身(如屏幕尺寸和对比度、联通性、内存等)以及与其使用相关的外部因素(不同环境下的照明或噪声水平)。 |
不适用 |
2.8.4注册人/备案人应规定软件按照预期正常运行所必须的最低要求,如硬件、IT网络特性和IT网络安全措施,包括未经授权的访问。 |
不适用 |
2.8.5医疗器械的设计、生产和维护应能提供足够的网络安全水平,以防止未经授权的访问。 |
远程控制适用 |
2.9具有诊断或测量功能的医疗器械 |
|
2.9.1具有诊断或测量(包括监测)功能的医疗器械的设计和生产,应基于适当的科技方法,除其他性能外,还应确保相应的准确度、精密度和稳定性,以实现其预期目的。注册人/备案人应规定准确度限值(如适用)。为便于使用者理解和接受,数字化测量值应以标准化单位表示(如可能),推荐使用国际通用的标准计量单位,考虑到安全、使用者的熟悉程度和既往的临床实践,也可使用其他公认的计量单位。医疗器械导示器和控制器的功能应有详细的说明,若器械通过可视化系统提供与操作、操作指示或调整参数有关的说明,该类信息应能够被使用者和患者(适用时)理解。 |
不适用 |
2.10说明书和标签 |
|
2.10.1医疗器械应附有识别该器械及其注册人/备案人所需的信息。每个医疗器械还应附有相关安全和性能信息或相关指示。这些信息可出现在器械本身、包装上或使用说明书中,或者可以通过电子手段(如网站)便捷访问,易于被预期使用者理解。 |
适用 |
2.11辐射防护 |
|
2.11.1医疗器械的设计、生产和包装应当考虑尽量减少使用 者、他人和患者(如适用)的辐射吸收剂量,同时不影响其诊断或治疗功能。 |
含光源产品适用 |
2.11.2具有辐射或潜在辐射危害的医疗器械,其操作说明应 详细说明辐射的性质,对使用者、他人或患者(若适用)的防护措施,避免误用的方法,降低运输、贮存和安装的风险。 |
不适用 |
2.11.3若医疗器械有辐射或有潜在辐射危害,应具备辐射泄 漏声光报警功能(如可行)。 |
不适用 |
2.11.4医疗器械的设计和生产应降低使用者、其他人员或患 者(若适用)暴露于非预期、偏离或散射辐射的风险。在可能和适当的情况下,应采取措施减少使用者、其他人员或患者(若适用)等可能受影响的人在辐射中的暴露。 |
含光源产品适用适用 |
2.11.5具有辐射或潜在辐射危害且需要安装的医疗器械,应 在操作说明中明确有关验收和性能测试、验收标准及维护程序的信息。 |
不适用 |
2.11.6若医疗器械对使用者有辐射或潜在辐射危害,其设计 和生产应确保辐射剂量、几何分布、能量分布(或质量)以及其他辐射关键特性能够得到合理的控制和调整,并可在使用过程中进行监控(如适用)。上述医疗器械的设计和生产,应确保相关可变参数的重复性在可接受范围内。 |
不适用 |
2.12对非专业用户使用风险的防护 |
|
2.12.1对于非专业用户使用的医疗器械(如自测或近患者检 测),为保证医疗器械的正常使用,其设计和生产应考虑非专业用户的操作技能,以及因非专业用户技术和使用环境的不同对结果的影响。注册人/备案人提供的信息和说明应易于理解和使用,并可对结果做出解释。 |
不适用 |
2.12.2供非专业用户使用的医疗器械(如自测或近患者检测) 的设计和生产应:确保使用者可以按照使用说明书的规定安全准确的使用。当无法将与说明书相关的风险降低到适当水平时,可以通过培训来降低此类风险;尽可能减少非专业用户因错误操作和错误解释结果导致的风险。 |
不适用 |
2.12.3供非专业用户使用的医疗器械可通过以下措施方便用户: 在使用时,可以验证器械的正常运行; 当器械不能正常运行或提供无效结果时,会发出警告。当器械不能正常运行或提供无效结果时,会发出警告。 |
不适用 |
2.13含有生物源材料的医疗器械 |
|
2.13.1对于含有动植物组织、细胞或其它物质,细菌来源物 质或衍生物的医疗器械,若无活性或以非活性状态交付,应: 组织、细胞及其衍生物应来源于已受控且符合预期用途的动物种属。动物的地理来源信息应根据相关法规要求予以保留。 动物源的组织、细胞、物质或其衍生物的采集、加工、保存、检测和处理过程,应确保患者、使用者以及其他人员(如适用)的安全。特别是病毒和其他传染性病原体,应通过经验证的先进技术消除或灭活,影响医疗器械性能的情况除外。 |
不适用 |
2.13.2对于监管部门而言,当医疗器械由人体来源的组织、细胞、物质或其衍生物生产时,应采取以下措施: 组织、细胞的捐赠、获取和检测应依据相关法规的要求进行; 为确保患者、使用者或他人的安全,应对组织、细胞或其衍生物进行加工、保存或其他处理。对于病毒和其他传染源,应通过源头控制,或在生产过程中通过经验证的先进技术消除或灭活。 |
不适用 |
2.13.3当医疗器械使用2.13.1、2.13.2以外的生物物质(例如植物或细菌来源的材料)生产时时,其加工、保存、检测和处理应确保患者、用户以及其他人员(如废弃物处置人员等)的安全。对于病毒和其他传染源,为确保安全,应通过源头控制,或在生产过程中通过经验证的先进技术消除或灭活。 |
不适用 |
3.1化学、物理和生物学特性 |
|
3.1.1根据医疗器械的预期用途,以及产品(例如某些可吸收产品)在人体的吸收、分布、代谢和排泄情况,对于医疗器械的化学、物理和生物学特性,应特别注意所用材料/物质与人体组织、细胞和体液之间的相容性。 |
适用 |
3.1.2医疗器械的设计和生产,应当能够保证产品在预期使用中接触到其他的材料、物质和气体时,仍然能够安全使用。如果医疗器械用于配合药物使用,则该产品的设计和生产需要符合药品管理的有关规定,且具有药物相容性,同时药品和器械的性能符合其适应证和预期用途。 |
适用 |
3.1.3医疗器械的设计和生产,除接触完整皮肤的产品外,应适当降低释放进入患者或使用者体内的颗粒,产生与颗粒尺寸和性质相关的风险。对纳米材料应给予重点关注。 |
不适用 |
3.2辐射防护 |
|
3.2.1用于医学影像的医疗器械具有电离辐射时,其设计和生产,在保障图像和/或输出质量的同时,应尽可能降低患者、使用者和其他人员的辐射吸收剂量。 |
不适用 |
3.2.2具有电离辐射的医疗器械应能够精确预估(或监测)、 显示、报告和记录治疗过程中的辐射剂量。 |
不适用 |
3.3植入医疗器械的特殊要求 |
|
3.3.1植入医疗器械的设计和生产,应能消除或降低相关治疗风险,例如除颤器、高频手术设备的使用。 |
不适用 |
3.3.2可编程有源植入式医疗器械的设计和生产,应保证产品在无需手术时即可准确识别。 |
不适用 |
3.4提供能量或物质的医疗器械对患者或使用者的风险防护 |
|
3.4.1用于给患者提供能量或物质的医疗器械,其设计和生产应能精确地设定和维持输出量,以保证患者、使用者和其他人的安全。 |
不适用 |
3.4.2若输出量不足可能导致危险,医疗器械应当具有防止和/或指示“输出量不足”的功能。意外输出危险等级量的能量或物质作为较大风险,应采取适当的措施予以降低。 |
不适用 |
3.5含有药物成分的组合产品 |
|
3.5.1当医疗器械组成成分中含有某种物质,依据监管法规,该物质作为药用产品/药物进行管理,且该物质在体内为医疗器械提供辅助作用时,应将医疗器械和此物质作为一个整体,对其安全和性能进行验证,同时应验证该物质的特征、安全、质量和有效性。 |
不适用 |
附件4:产品技术要求编写示例
医疗器械产品技术要求编号:
腹腔内窥镜手术系统
产品型号/规格及其划分说明
产品型号:
医生控制台**、患者手术平台**,影像处理平台***,内窥镜***
手术器械型号见附录C(数量较少时也可在此处直接列出)。
软件版本和版本号命名规则:
版本号命名规则
发布版本号
性能指标
医生控制台
患者手术平台
三维内窥镜
手术器械通用要求
表面光洁度
尺寸
表面粗糙度
硬度
运动范围
配合
化学性能
微生物
……
持针钳专用要求
抓钳专用要求
高频电勾专用要求
超声切割止血刀头专用要求
吻合器专用要求
血管闭合器专用要求
脚踏开关
系统要求
需引用YY/T 1712 标准中的适用要求
软件功能
整机噪声
网络安全(如适用)
2.16.1数据接口:传输协议/存储格式;
2.16.2用户访问控制:用户身份鉴别方法、用户类型及权限。
安全要求
GB9706.1-2007, GB9706.4-2009, GB9706.15-2008, GB9706.19-2000和GB7247.1-2012的所规定的要求,产品特征见附录A。
电磁兼容要求
应符合YY 0505-2012的要求。
检验方法
试验条件
术语和定义
附录A 安全主要安全特征
可按医生控制台、患者手术平台、影像处理平台分别描述
附录B产品结构组成图示
包括各组成部分图示及说明、各部件之间以及与网电源之间的连接关系
附录C手术器械列表
本审评要点旨在指导注册申请人对食道支架产品注册申报资料的准备及撰写,同时也为技术审评部门审评注册申报资料提供参考。
本审评要点是对食道支架产品的一般要求,不包含临床评价内容,注册申请人应依据产品的具体特性确定其中内容是否适用,若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容进行充实和细化。
一、适用范围
本审评要点适用于自扩张食道支架产品注册。自扩张食道支架通常由支架和/或输送系统组成。支架采用金属材料制成,可覆高分子材料制成的膜。其他非血管自扩张金属支架可参考本审评要点。
按现行《医疗器械分类目录》,该类产品分类编码为13-09-06,管理类别为Ⅲ类。
二、注册申报资料要求
注册申报资料应按照《医疗器械注册申报资料要求及说明》提供,尤其注意以下几方面内容:
(一)产品的综述资料
1.产品名称:产品名称一般体现植入部位、是否带有覆膜等特点,宜参照《无源植入器械通用名称命名指导原则》。
2.提供产品各型号规格的划分依据,明确各型号间的异同点(同一型号的产品应具有材料、特性、结构上的同一性)。
3.产品基本信息
(1)产品组成材料:需明确支架及输送系统各部件组成及材料的基本信息,如化学名称、化学结构式/分子式(必要时)、材料商品名(若有)、材料代号/牌号(若有)等。若原材料外购,需明确原材料供应商,提交原材料的质控标准及检测报告。若原材料为自行合成,需阐述材料生产过程中的质量控制标准并提交相关的检测报告。
(2)结构及图示:提供产品整体结构示意图(近端/远端构型)、各个组件结构示意图、局部细节示意图(如编织方式、支架桥接点等)。
描述产品结构、尺寸(支架长度、外径、厚度、支架编织丝材直径和数量、配用导引导丝最大外径等)和编织与加工技术等,必要时提供图示。
(二)非临床资料
1. 产品性能研究
申请人需提交产品性能研究资料,包括:
(1)详述性能研究中保证产品安全有效的性能要求及检验方法的确定依据,提供涉及到的研究性资料、文献资料和/或标准文本。
(2)申请人需参照《医疗器械安全和性能基本原则》,结合产品设计特征、设计输入要求等对支架相关性能进行研究,包括但不限于外观、尺寸(外径、长度、工作尺寸范围、壁厚或内径)、支架的扩张力、压缩力、射线可探测性、终产品的镍钛合金相变温度、回收线/环与支架连接强度、金属材料化学成分、金属材料显微结构、回收性能(如适用)、耐腐蚀性等。对于覆膜支架,建议补充覆膜支架的破裂强度、纵向拉伸强度、加工吻合强度、缝合强度、与移植物连接的植入物/附着系统的强度(如适用)、膜与支架的结合强度、还原物质、重金属、酸碱度、蒸发残渣、紫外吸光度等适用的项目,如不适用,需说明理由。
(3)输送系统相关性能要求:申请人需对外观、尺寸(外径、长度)、放置性能、拉伸性能、无泄漏、输送系统水流量(如适用)、连接器牢固度、射线可探测性、还原物质、重金属、酸碱度、蒸发残渣、紫外吸光度、耐腐蚀性等适用的项目,如不适用,需说明理由。
(4)MRI相容性评价:申请人需提供支架的MRI相容性研究资料,包括位移、温升、扭矩以及伪影等。
2. 生物学评价
需根据产品接触方式以及接触时间,按照GB/T 16886《医疗器械生物学评价》系列标准进行生物学评价,涉及的评价终点包括:细胞毒性、迟发型超敏反应、遗传毒性、植入反应、全身急性毒性、刺激或皮内反应、亚慢性毒性等。若申报产品含有未在国内已上市的持久植入性医疗器械中使用的材料,需考虑额外的生物学评价终点。
对于用于扩张恶性狭窄的支架,可不提交遗传毒试验资料。如植入和亚慢性毒性研究的病理及毒理学数据没有可疑参数,可不提交慢性毒性试验资料。
3. 其他资料
对于符合《免于临床评价医疗器械目录》(以下简称《目录》)的食道支架,申请人需提交申报产品相关信息与《目录》所述内容的对比资料以及申报产品与《目录》中已获准境内注册的医疗器械的对比说明,包括材质(包括具体牌号)、产品结构、组成部件、尺寸、力学性能(如扩张力、压缩力、破裂强度/覆膜完整性/纵向拉伸强度、缝合强度)、放置性能、植入部位等方面的差异,并提供差异对产品安全性有效性未造成不利影响的支持资料。
对于新型结构设计、新型作用机理的产品,或药械组合医疗器械,如可携带粒子的食道支架,不属于《目录》描述范围的产品,申请人宜进行临床评价。
本审评要点旨在指导注册申请人对3D打印椎间融合器产品注册申报资料的准备及撰写,同时也为技术审评部门审评注册申报资料提供参考。
本审评要点是对3D打印椎间融合器产品的一般要求,注册申请人应依据产品的具体特性确定其中内容是否适用,若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容进行充实和细化。
一、适用范围
本审评要点适用于3D打印椎间融合器产品注册,3D打印椎间融合器产品通常采用TC4或TC4 ELI钛合金粉末激光或者电子束熔融等增材制造工艺制造。该产品不包括对特殊设计的产品如自稳定型、可撑开型、分体组合式等椎间融合器的要求,但适用部分可以参考本审评基本要求中相应的技术内容。
按现行《医疗器械分类目录》,该类产品分类编码为13-03-04,管理类别为三类。
二、基本要求
3D打印椎间融合器可参照《椎间融合器注册技术审查指导原则》、《3D打印人工椎体注册技术审查指导原则》等相关指导原则的要求提交研究资料。
三、风险管理
根据YY/T 0316-2016《医疗器械风险管理对医疗器械的应用》,充分识别3D打印椎间融合器产品的设计、原材料采购、增材制造生产加工过程、后处理、产品包装、灭菌、运输、贮存、使用等产品生命周期内各个环节的安全特征,从生物学危险(源)、环境危险(源)、有关植入过程的危险(源)、由功能失效、疲劳所引起的危险(源)等方面,对产品进行全面的风险分析,并详述所采取的风险控制措施。
提供3D打印椎间融合器产品上市前对其风险管理活动进行全面评审所形成的风险管理报告,此报告旨在说明并承诺风险管理计划已被恰当地实施,并经过验证后判定综合剩余风险是可接受的,已有恰当的方法获得产品设计、制造、出厂后流通和临床应用的相关信息。
风险管理报告应包括风险分析、风险评价、风险控制等产品风险管理的相关资料,至少应包括产品安全特征清单、产品可预见的危害及危害分析清单(说明危害、可预见事件序列即危害成因分析)、危害处境和可能发生的损害之间的关系、风险评价、风险控制措施以及剩余风险评价汇总表。
四、产品研究
3D打印椎间融合器研究资料需重点关注以下方面要求:
(一)产品的物理和化学性能
3D打印椎间融合器的原材料质控要求、关于多孔部分最小结构单元、理化性能研究及缺陷控制、产品的金属离子析出研究可参考《3D打印人工椎体注册技术审查指导原则》和《3D打印髋臼杯产品注册技术审查指导原则》的要求提交研究资料。
(二)产品的机械性能
1. 3D打印椎间融合器的动静态力学试验
建议按照YY/T 0959标准实施动静态力学性能试验,颈椎融合器提供包括压缩、剪切和扭转的动静态力学测试报告,胸腰椎融合器提供包括压缩、剪切的动静态力学测试报告。测试报告应包含测试样品信息、设备型号、工装材质、加载方式、椎间盘高度、实际试验图片、各个样品静态测试载荷-位移曲线和动态测试载荷-循坏次数曲线、数据处理、样品失效模式等相应信息。请考虑不同型号规格融合器的植骨区尺寸(如适用)、侧开口窗尺寸(如适用)、倾角、长度、宽度和高度等因素,分别选取颈椎和胸腰椎融合器的最差情况进行上述试验,并提供选择依据。请分别提供颈椎和胸腰椎融合器产品的力学性能试验结果在临床应用中可接受的依据,对申报产品与同品种产品的力学性能差异,以及失效形式的差异,如多孔结构断裂形式、粉末析出等情况进行具体描述,需分析论证可接受性。
2. 3D打印椎间融合器的静态轴向压缩沉陷试验
建议按照YY/T 0960规定的试验方法评价3D打印椎间融合器在静态轴向压缩载荷下的沉陷倾向。
3. 3D打印椎间融合器的抗冲击性能
考虑到3D打印椎间融合器在打入椎体间隙时,敲击可能造成融合器多孔结构、多孔结构与实体结合处发生断裂失效,建议结合椎间融合器结构设计(多孔结构和实体结构)、持取器与融合器的机械配合设计、不同设计的植入椎间隙的阻力等因素,提供产品的抗冲击性能研究资料。
4. 3D打印椎间融合器的防脱出性能
考虑3D打印椎间融合器在植入初期未形成骨长入的情况下存在脱出的风险,建议结合椎间融合器表面防脱出结构设计,提供3D打印椎间融合器的防脱出性能研究资料。
(三)生物学特性研究
产品的生物相容性评价,需结合产品耐腐蚀性和金属离子析出行为研究,按照GB/T 16886.1-2011《医疗器械生物学评价第1部分:风险管理过程中的评价与试验》中的系统方法框图及《国家食品药品监督管理局关于印发医疗器械生物学评价和审查指南的通知》(国食药监械〔2007〕345号)中的审查要点进行风险评价,必要时根据GB/T 16886系列标准进行生物学试验。
(四)热原和细菌内毒素
考虑到3D打印椎间融合器多孔结构可能存在残留粉末和细菌尸体,需要针对热原和细菌内毒素进行验证。
(五)MRI相容性测试
如申请人对申报产品进行了MRI相容性的相关验证,应根据研究报告,列出MRI试验设备、磁场强度、比吸收率(SAR)等试验参数及温升、位移力及伪影评估结果。如申请人未对申报产品进行MRI相容性的相关验证,应重点明确该产品尚未在磁共振(MRI)环境下对该产品的温升、移位状况及伪影进行测试评估。并在说明书的警示中注明相关内容,提示其存在的风险。
(六)清洗和灭菌研究
清洗工艺验证和灭菌工艺验证应根据产品特点选择最差情况,如清洗工艺验证中考虑材料残留,灭菌工艺验证中考虑表面积、孔隙率、孔径等影响微生物负载的因素。论证清洗验证方法的有效性,必要时应采用破坏性试验对其清洗方法进行验证。考虑到增材制造工艺的复杂性,其多孔结构的清洗工艺验证应由申请人完成。
(七)稳定性研究
3D打印椎间融合器的有效期验证可参考《无源植入性医疗器械货架有效期注册申报资料指导原则》。
(八)动物试验
3D打印椎间融合器产品多孔结构特征对骨长入效果的影响,关注植入后新骨形成、界面结合情况、骨长入深度、骨长入时间、局部组织反应的评价等。如无法通过与已上市产品的多孔结构特征进行等同性论证,通过动物试验证明该多孔结构对骨生长的效果。如需开展动物试验研究,需按照《医疗器械动物试验研究技术审查指导原则》(第一部分:决策原则和第二部分:实验设计、实施质量保证)进行,并遵循3R原则;需关注动物模型建立的科学性和合理性,以及对临床的借鉴意义。
五、临床研究
该产品目前尚不属于《医疗器械监督管理条例》中规定的免于进行临床评价的产品情形,申请人需按照《医疗器械临床评价技术指导原则》的要求选择合适的临床评价路径提交临床评价资料。临床评价可以根据产品特征、临床风险、已有临床数据等情形,通过开展临床试验,或者通过对同品种医疗器械临床文献资料、临床数据进行分析评价,证明医疗器械安全、有效。
(一)同品种医疗器械评价路径
详见《医疗器械临床评价技术指导原则》中通过同品种医疗器械临床试验或临床使用获得的数据进行分析评价的要求。
(二)临床试验评价路径
对于选择开展临床试验的情况,可参照《椎间融合器注册技术审查指导原则》、《医疗器械临床评价技术指导原则》、《医疗器械临床试验设计指导原则》等指导原则的相关内容,并提交完整的临床试验资料。
申请人如有境外临床试验数据,可参照《接受医疗器械境外临床试验数据技术指导原则》的要求提交相关临床试验资料。
六、说明书
产品说明书应符合《医疗器械说明书和标签管理规定》要求,还应符合相关国家标准、行业标准的要求,例如 YY/T 0466.1-2016《医疗器械用于医疗器械标签、标记和提供信息的符号第1部分:通用要求》。
七、其他
3D打印椎间融合器产品生产制造相关要求可参考《3D打印人工椎体注册技术审查指导原则》和《3D打印髋臼杯产品注册技术审查指导原则》的要求提交研究资料。详述3D打印椎间融合器产品的生产过程,提供生产工艺流程图。对增材制造医疗器械的生产和验证过程,如设计软件、打印设备、打印工艺、后处理工艺、清洗工艺等方面进行控制。
附录1:产品适用的相关标准
包括但不仅限于以下标准:
GB/T 228.1金属材料拉伸试验第1部分室温试验方法
GB/T 10610 产品几何技术规范(GPS) 表面结构轮廓法评定表面结构的规则和方法
GB/T 5168 α-β钛合金高低倍组织检验方法
GB/T 4698 (所有部分) 海绵钛、钛及钛合金化学分析方法
GB/T 13810 外科植入物用钛及钛合金加工材
GB/T 33582 机械产品结构有限元力学分析通用原则
YY/T 0316 医疗器械风险管理对医疗器械的应用
YY/T 1427 外科植入物可植入材料及医疗器械静态和动态腐蚀试验的测试溶液和条件
YY/T 1552 外科植入物评价金属植入材料和医疗器械长期腐蚀行为的开路电位测量方法
GB/T 14233.1医用输液、输血、注射器具检验方法第1部分:化学分析方法
GB/T 14233.2医用输液、输血、注射器具检验方法第2部分:生物学试验方法
GB/T 16886.1医疗器械生物学评价第1部分:风险管理过程中的评价与试验
GB/T 35021 增材制造工艺分类及原材料
GB/T 35351 增材制造术语
GB/T 36984外科植入物用多孔金属材料X射线CT检测方法
YY 0341.2 无源外科植入物骨接合与脊柱植入物第2部分:脊柱植入物特殊要求
YY/T 1502 脊柱植入物椎间融合器
YY/T 0343外科金属植入物液体渗透检验
YY/T 0640 无源外科植入物通用要求
YY/T 0466.1 医疗器械用于医疗器械标签、标记和提供信息的符号第1部分:通用要求
YY/T 0959 脊柱植入物椎间融合器力学性能试验方法
YY/T 0960 脊柱植入物椎间融合器静态轴向压缩沉陷试验方法
GB 18278系列标准
GB 18279 系列标准
GB 18280 系列标准
WS310.2 《医院消毒供应中心第2部分:清洗消毒及灭菌技术操作规范》
ASTM F2077 Test Methods for Intervertebral Body Fusion Devices
ASTM F2267 Standard Test Method for Measuring Load Induced Subsidence of Intervertebral Body Fusion Device Under Static Axial Compression
ASTM F2119 Standard Test Method for Evaluation of MR Image Artifacts from Passive Implants
ASTM F2182 Standard Test Method for Measurement of Radio Frequency Induced Heating Near Passive Implants During Magnetic Resonance Imaging
ASTM F2213 Standard Test Method for Measurement of Magnetically Induced Torque on Medical Devices in the Magnetic Resonance Environment
ISO 17296-2 Additive manufacturing -- General principles -- Part 2: Overview of process categories and feedstock
ISO 17296-3 Additive manufacturing -- General principles -- Part 3: Main characteristics and corresponding test methods
ISO 17296-4 Additive manufacturing -- General principles -- Part 4: Overview of data processing
ISO 19227 Implants for surgery -- Cleanliness of orthopedic implants -- General requirements
ASTM F3335 Standard Guide for Assessing the Removal of Additive Manufacturing Residues in Medical Devices Fabricated by Powder Bed Fusion ASTM F3122 Standard Guide for Evaluating Mechanical Properties of Metal Materials Made via additive manufacturing process
ISO/ASTM 52921 Standard terminology for additive manufacturing -- Coordinate systems and test methodologies
ISO/ASTM52915 Specification for additive manufacturing file format (AMF) Version 1.2
ISO/ASTM 52901 Additive manufacturing -- General principles -- Requirements for purchased AM parts
ISO/ASTM 52900 Additive manufacturing -- General principles – Terminology
ISO/ASTM 52910 Additive manufacturing -- Design -- Requirements, guidelines and recommendations
ASTM F2924 Standard Specification for Additive Manufacturing Titanium-6 Aluminum-4 Vanadium with Powder Bed Fusion
ASTM F3001 Standard Specification for Additive Manufacturing Titanium-6 Aluminum-4 Vanadium ELI (Extra Low Interstitial) with Powder Bed Fusion
ASTM F3049 Standard Guide for Characterizing Properties of Metal Powders Used for Additive Manufacturing Processes
附录2:产品适用的指导原则
《医疗器械注册单元划分指导原则》
《椎间融合器注册技术审查指导原则》
《无源植入性医疗器械货架有效期注册申报资料指导原则(2017年修订版)》
《医疗器械动物试验研究注册审查指导原则第一部分:决策原则(2021年修订版)》
《医疗器械动物试验研究注册审查指导原则第二部分:试验设计、实施质量保证》
《医疗器械临床评价技术指导原则》
《医疗器械临床试验质量管理规范》
《接受医疗器械境外临床试验数据技术指导原则》
本审评要点旨在指导注册申请人对预充式导管冲洗器产品注册申报资料的准备及撰写,同时也为技术审评部门审评注册申报资料提供参考。
本审评要点是对预充式导管冲洗器产品的一般要求,不包含临床评价内容,注册申请人应依据产品的具体特性确定其中内容是否适用,若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容进行充实和细化。
一、适用范围
本审评要点适用于预充式导管冲洗器产品注册。
“预充式导管冲洗器”又名“预冲式冲管注射器”。通常由外套、芯杆、活塞、锥头护帽和预充0.9%氯化钠注射液组成,经湿热灭菌。常见适用范围:用于不同药物输注治疗的间隙,封闭、冲洗导管的管路末端。
按现行《医疗器械分类目录》,该类产品分类编码为14-16-03,管理类别为Ⅲ类。
二、基本要求
该产品在我国按照Ⅲ类医疗器械管理。相关文件专门规定:为保证产品的安全性,该产品生产过程除须符合《医疗器械生产质量管理规范》及相关规定外,其预充氯化钠注射液的生产灌装过程还应同时符合《药品生产质量管理规范》的有关规定;产品中预充的氯化钠注射液应取得我国的药品批准证明文件,并符合《中华人民共和国药典》关于氯化钠注射液的检验要求。
(一)我国适用指导原则及适用情况
见附录1。
(二)我国适用标准及适用情况
见附录2。
此外,申报文件还可以参考的文件包括:《医疗器械分类目录》2017版、《关于公布医疗器械注册申报资料要求和批准证明文件格式的公告》(2021年第121号)、《关于发布医疗器械临床评价技术指导原则等5项技术指导原则的通告》(2021年第73号)等。
三、风险管理
产品首先应通过安全设计和生产消除或适当降低风险;必要时,应对无法消除的风险采取充分的防护措施(包括必要的警报),保证每个危险(源)相关的剩余风险和总体剩余风险是可接受的。
关注根据申报资料能否判断在正常使用条件下,申报产品所有已知的、可预见的风险以及任何不良副作用为最小化且可接受,其性能带来的受益大于风险。
四、产品研究
(一)通用要求
所有申报文件的格式和内容,应符合《关于公布医疗器械注册申报资料要求和批准证明文件格式的公告(2021年第121号)》文件的要求。
根据《医疗器械分类目录》关注所申报产品管理类别、分类编码填写是否正确。关注研发历程和参考同类/前代产品情况,对于同类产品,判断选择其作为研发参考的理由是否充分。对于存在多种型号规格的产品,应当关注各型号规格的区别。根据《医疗器械注册单元划分指导原则的通告》(2017年第187号)文件内容,关注是否属于同一注册单元。
对于进口产品,需关注是否提供了产品在境外上市情况的有关信息,是否有不良事件或召回等情形。
(二)产品技术要求和检测
产品技术要求的制定应符合《医疗器械产品技术要求编写指导原则》的法规要求。申请人应根据产品的技术特征和临床使用情况来确定产品安全有效、质量可控的技术要求与检验方法。除外一次性使用输注器具产品制定技术要求的常见内容,还建议注意以下部分:
1. 产品组成与申请表和说明书等处一致。
2. 产品中氯化钠溶液应符合《中国药典》氯化钠注射液项下所有要求,包括装量、不溶性微粒、可见异物等。检测方法应采用中国药典规定方法。
3. 产品中如果添加防腐剂等成分,应说明并补充相应的要求,论证其安全性。若注射器等组件在灌装氯化钠注射液前采用环氧乙烷灭菌,建议增加对产品环氧乙烷及其降解产物的限量控制。
4. 考虑到可见异物等性能指标与产品装量有关,建议选择最大容量产品作为典型性产品进行全项目检测,其他型号进行差异化检测。
(三)实验室研究
除外一次性使用输注器具产品常见实验室研究内容外,需要提供药物相容性研究资料,大致如下:
1. 药物相容性研究
该产品外套、芯杆、锥头护帽材质通常为聚丙烯,活塞材质常见为溴化丁基橡胶或氯化、卤化丁基橡胶活塞。这些与液体接触部件在产品中类似氯化钠注射液的包装。根据《化学药品注射剂与塑料包装材料相容性研究技术指导原则(试行)》、《化学药品与弹性体密封件相容性研究技术指导原则(试行)》规定,要求申请人提供氯化钠注射液和上述与液体接触部件的药物相容性研究文件。建议使用全谱扫描方法进行观察,确定与液体接触部件是否有进一步降解物和新的物质产生。经过总结得出与液体接触部件是否适用于药品,进而保证产品安全性和有效性的结论。通常选择单位毫升药液和与液体接触组件的面积和克重最大的型号作为药物相容性研究的典型性型号,申请人应对此作出专门的说明,并根据典型性型号的检测结果,推算本注册单元所有型号的安全性。在计算浸出物AET限值的时候,应考虑临床使用的最大量,申报产品每日用量宜不低于5支,氯化钠注射液用量宜不低于20 mL。
1.1 提取试验
首先提供与液体接触部件原材料(如聚丙烯、溴化丁基橡胶等)组分信息,采用适宜的溶剂,在较剧烈的条件下,对与液体接触部件材料进行的提取试验研究;对可提取物(与液体接触部件材料中溶出的添加物、单体及其降解物等)进行初步的风险评估并明确潜在的目标浸出物,指导后续的浸出物研究(迁移试验)。
依照与液体接触部件原材料组分信息,进行适宜的与液体接触部件材料样品前处理,至少使用0.9%氯化钠注射液作为提取溶剂,可适当增加酸性缓冲液、碱性缓冲液和乙醇水等作为提取溶剂。确定合适的提取条件(应比灭菌条件更苛刻,提取温度优先选择在灭菌温度基础上适当增加)和分析方法,对挥发性有机物、半挥发有机物、不挥发物、元素分析等开展提取试验研究,对在提取试验研究中获得的高于分析评价阈值(AET)水平的可提取物进行鉴别,预测潜在的可浸出物,包括单体、起始物质、残留物、降解物质、添加剂等。从而对可提取物进行初步的风险评估并预测潜在的浸出物。当研究发现产品中可能存在特殊关注物质时(如多环芳烃、亚硝胺等),应开发高灵敏度的专属的并满足更低的检测限和定量限的检测方法对其进行检测及安全性评估。
1.2 相互作用研究
包括迁移试验和吸附试验。迁移试验用于考察从与液体接触部件材料中迁移并进入制剂中的物质。吸附试验则用于考察由于与液体接触部件吸附可能引发的活性成分或功能性辅料含量的下降。通过加速和/或长期稳定性试验(注意氯化钠注射液应与包装材料充分接触)增加相应潜在目标浸出物的检测指标,获得药品中含有的浸出物信息及与液体接触部件材料对氯化钠注射液的吸附数据。通常以长期稳定性试验观察结果为准。
一般选择按正常条件生产、包装、放置的产品,相互作用研究考察项目可分为物理、化学、生物等几个方面。至少采用3批产品进行研究。
1.2.1 迁移试验
应根据提取试验中获得的可提取物信息设定潜在的目标浸出物,以及在放置过程中,与液体接触部件材料成分中的降解物质或其他新生成物质。从而获得与液体接触部件材料(如聚丙烯、溴化丁基橡胶等)在0.9%氯化钠注射液中出现的浸出物信息。考察时间点根据上述指导原则和长期稳定性试验进行设置(如0、3、6、9、12月等),至少应包括起点和终点,中间点可适当调整。提供聚丙烯、溴化丁基橡胶中各种添加剂,在上述考察时间点的浸出试验结果分析与安全性评价文件。在迁移试验中应对高于分析评价阈值(AET)水平的相关浸出物进行鉴别、定量,并评估浸出物的安全性。
1.2.2 吸附试验
通常可选择留样试验的考察时间点(如0、3、6、9、12月等),按照中国药典氯化钠注射液项目进行检验,观察与液体接触部件对0.9%氯化钠注射液的吸附。
1.2.3 安全性研究
根据提取试验获得的可提取物信息及迁移试验获得的浸出物信息,进行安全性分析。
可以通过文献及毒性数据库查询相关的毒性资料,换算成人每日允许最大暴露量(Permitted Daily Exposure,PDE),或参考GB/T 16886.17文件推导合理的TI值。如果文献及毒性数据库无相关浸出物的毒性资料,也未采用相应的浸出物进行安全性研究,则可依据安全性阈值(Safety Concern Threshold,SCT),评估浸出物是否存在安全性风险。
2. 微生物侵入试验
该产品通常依靠护帽、活塞、外套来保证无菌状态,对此补充微生物侵入试验文件,建议至少选择新生产的产品、到达长期实时老化有效期产品分别进行密封性验证试验,考虑检查方法的灵敏度和适用性等,基于风险评估,选择适宜的密封性检查方法。微生物挑战法建立时需关注微生物的种类、菌液浓度、培养基种类和暴露时间等,结果判断应有正当的依据。
3. 有效期研究
产品有效期应结合长期实时老化有效期验证、药物相容性研究和微生物侵入试验结果来共同确认。长期实时老化验证报告中,按照中国药典对药物制剂稳定性试验和0.9%氯化钠注射液的规定,提供各时间点技术要求中包括氯化钠注射液全部要求在内的与有效期相关条款的检测报告。
4. 其他研究
按照一次性使用输注器具产品常见研究内容要求,提供生物相容性评价研究、灭菌工艺研究、包装研究等文件,以证明产品是否具有可接受的稳定性,使用性能、安全和无菌保证水平是否能够确保。
五、临床研究
目前该产品未列入《免于临床评价医疗器械目录》,按照《关于发布医疗器械临床评价技术指导原则等5项技术指导原则的通告》(2021年第73号)的要求,提供临床评价资料。
六、说明书
关注是否提供了拟申报范围内的所有规格型号产品的说明书,或是否覆盖产品所有组成部分。
说明书和标签中产品适用范围应与临床评价内容一致。若预期用于冲洗中心静脉导管或经外周中心静脉导管,需在说明书中给出其与预期冲洗导管的兼容性的说明或警示。注意事项中补充“该产品的使用需符合静脉治疗护理技术操作规范”。产品外包装不能证明为无菌屏障的,应在注意事项中列明“不得将本产品置于灭菌界面或无菌环境”。
七、其他
除外一次性使用输注器具产品常见原材料要求,境内产品氯化钠溶液应提供我国药品注册证,进口产品的氯化钠注射液应提供在原产国(地区)上市证明文件。
聚丙烯原材料建议提供符合聚丙烯输液瓶药品包材标准YBB00022002-2015中适宜项目、YY/T 0242规定项目的检测报告。活塞建议提供符合预灌封注射器用溴化丁基橡胶活塞标准YBB 00082004-2015或预灌封注射器用氯化丁基橡胶活塞标准YBB 00072004-2015、注射液用卤化丁基橡胶活塞标准YBB 00042005-2015全部项目的检测报告。如申报产品聚丙烯原材料、活塞取得相应药包材证明文件,建议提供。
附录1:指导原则适用情况
指导原则名称 |
适用情况 |
一次性使用输注器具产品注册技术审查指导原则 |
除氯化钠注射液以外其他组件的相关要求,包括使用性能、原材料、灭菌验证、有效期验证等。 |
化学药品注射剂与塑料包装材料相容性研究技术指导原则(试行) |
观察液体接触部件(除外弹性密封件)对氯化钠注射液的影响以及氯化钠注射液对液体接触部件(除外弹性密封件)的影响。 |
化学药品与弹性体密封件相容性研究技术指导原则(试行) |
观察弹性密封件与氯化钠注射液接触后的可沥滤物水平、对氯化钠注射液中的有效成分或功能性辅料的吸附等。 |
化学药品注射剂与药用玻璃包装容器相容性研究技术指导原则 |
部分金属元素PDE数值的评估 |
医疗器械产品技术要求编写指导原则 |
全部适用 |
医疗器械临床评价技术指导原则 |
全部适用 |
医疗器械注册单元划分指导原则的通告 |
仅产品预冲溶液是0.9%氯化钠注射液的,作为医疗器械管理。 |
附录2:标准适用情况
标准名称 |
适用情况 |
中国药典(最新版本) |
预充的氯化钠注射液应取得我国药品批准证明文件,符合《中华人民共和国药典》氯化钠注射液检验要求。 |
化学药品注射剂包装系统密封性研究技术指南(试行) |
包装密封性检查方法的选择、灵敏度等内容。 |
聚丙烯输液瓶药品包材标准YBB00022002-2015 |
采用聚丙烯材质制造的与液体接触部件 |
预灌封注射器用溴化丁基橡胶活塞标准YBB 00082004-2015 预灌封注射器用氯化丁基橡胶活塞标准YBB 00072004-2015 注射液用卤化丁基橡胶活塞标准YBB 00042005-2015 |
溴化丁基橡胶活塞 氯化丁基橡胶活塞 卤化丁基橡胶活塞 |
YY/T 0242 医用输液、输血、注射器具用聚丙烯专用料 |
采用聚丙烯材质制造的部件 |
YY/T 16886系列标准 |
预期直接接触人体、进入人体液体的产品适用 |
本审评要点旨在指导注册申请人对2019新型冠状病毒核酸检测类产品注册申报资料的准备及撰写,同时也为技术审评部门审评注册申报资料提供参考。
本审评要点是对2019新型冠状病毒核酸检测类产品突变株检出能力评价的一般要求,注册申请人应依据产品的具体特性对注册申报资料的内容进行充实和细化。
一、适用范围
为评估新型冠状病毒突变株对2019新型冠状病毒检测试剂的影响,需对所有2019新型冠状病毒核酸检测试剂进行不同突变株检出能力的评价。本审评要点适用于进行首次注册申报、变更注册申报和延续注册申报的产品。
按照《体外诊断试剂分类规则》,该类产品分类编码为6840,管理类别为三类。
二、评价要求
企业应提交在符合质量管理体系的生产环境下生产的试剂盒进行的突变株检出能力评价研究资料,建议着重对以下内容进行评价研究。
(一)评价突变株类型
评价突变株应包括:Alpha(阿尔法)突变株、Beta(贝塔)突变株、Gamma(伽马)突变株、Delta(德尔塔)突变株、Lambda(拉姆达)突变株、Mu(缪)突变株、B.1.427/B.1.429突变株、Omicron(奥密克戎)突变株等。(根据病毒变异情况适时进行突变株补充)
(二)评价突变株方法
针对不同突变株,首先应在GISAID数据库中对该突变株近2个月内上传的所有序列进行下载,采用生物信息学分析对下载序列与检测试剂引物/探针进行比对。针对靶扩增区域存在突变位点的毒株序列,应明确突变毒株序列编号、突变位点位于引物/探针的具体位置、突变率,并提交比对图(在图中标出引物、探针,高亮突变位点)。
(三)评价结果分析
突变株经上述生物信息分析显示,检测试剂引物/探针存在下述任何一种情况时,均认为该突变对试剂检出能力存在潜在影响,应列明可能存在影响的位点,并采用人工合成样本进一步试验验证。
1. 存在碱基插入和/或碱基缺失;
2. 引物或探针序列上有≥2个的碱基突变;
3. 引物和探针合计存在≥2个碱基突变;
4. 引物探针序列3’端5个碱基以内有突变;
5. 突变频率≥0.1%(最近一个月上传的序列);
6. 由中国上传的序列,引物探针上存在突变位点;
7. 其他经企业分析认为存在潜在影响的情形。
(四)突变株验证
采用人工合成样本进行试验验证时,应依据注册批准的所有样本类型,分别进行稀释研究。研究应至少包含最低检出限和精密度研究。
本审评要点旨在指导注册申请人对髋关节假体产品注册申报资料的准备及撰写,同时也为技术审评部门审评注册申报资料提供参考。
本审评要点是对髋关节假体产品的临床评价要求,注册申请人应依据产品的具体特性确定其中内容是否适用,若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容进行充实和细化。
一、适用范围
本审评要点适用于常规设计的髋关节假体同品种临床评价,按现行《医疗器械分类目录》,该类产品分类编码为13-04-01,管理类别为III类。。常规设计的髋关节假体通常由髋臼杯、髋臼内衬、股骨球头、股骨柄组成,具体包括:
由符合GB/T19701标准的普通超高分子量聚乙烯、符合YYT0811标准的高交联超高分子量聚乙烯或符合YY/T 1294标准的陶瓷材料制成的髋臼内衬;由符合YY/T0117.3标准的铸造钴铬钼、符合YY/T0605-12标准的锻造钴铬钼或符合GB/T13810标准的TC4和TC4ELI合金制成的髋臼杯组件;由分别符合YY/T0605-9标准的高氮不锈钢、符合YY/T0117.3标准的铸造钴铬钼、符合YY/T0605-12标准的锻造钴铬钼或符合GB/T13810标准的TC4、TC4ELI和TC20制成的股骨柄组件;由符合YY/T0605-9标准的高氮不锈钢、符合YY/T0117.3标准的铸造钴铬钼、符合YY/T0605-12标准的锻造钴铬钼或符合YY/T 1294标准的陶瓷材料制成的股骨头,由纯钛或钙磷陶瓷制成的涂层。不包括新材料、特殊设计的髋关节假体和定制髋关节假体等。
与境内已上市产品相比,申报产品如具有全新的技术特性(如采用了全新的工作原理、技术、材质、结构设计、表面处理、手术方式等),或具有全新的临床适用范围,已有数据无法证明拟申报产品安全有效的,可考虑通过临床试验来获得临床数据。
二、同品种临床评价的基本要求
(一)同品种医疗器械的选择
注册申请人通过同品种比对方式开展髋关节假体的临床评价时,可选用一个或多个同品种医疗器械进行比对,宜优先选择与申报产品适用范围相同、技术特征相同或尽可能相似的产品作为同品种医疗器械。申报产品与同品种医疗器械技术特征差异越大,论证差异对安全有效性的影响难度越大。例如,材料牌号不同对产品性能影响较大,建议选择相同牌号材料产品作为同品种医疗器械。
(二)适用范围及临床使用相关信息的对比
明确适用范围以及临床使用相关信息的相同性和差异性,建议重点考虑以下内容对比(包括但不限于):
1.适应证,如骨性关节炎、类风湿关节炎、创伤性关节炎、股骨头坏死、股骨颈骨折、先天性髋臼发育不良伴骨关节炎或关节脱位、股骨近端肿瘤需切除股骨头和股骨颈的情形等;
2.适用人群,如年龄等;
3.疾病的严重程度和阶段,如适用的骨质条件(如Dorr分型)、先天性髋臼发育不良分级、股骨头坏死程度等;
4.使用方法,如适用的手术入路等;
5.禁忌证、警告及预防措施
6.其他,如表面置换、全髋/半髋置换、初次/翻修等。
(三)技术特征的对比
申报产品与同品种医疗器械技术特征对比着重关注以下对比内容,包括但不限于:
1.产品组成
注册申请人需提供申报产品与同品种医疗器械组件信息对比,明确产品的组成部件,以及预期配合的组件信息。
2.产品设计和关键尺寸
注册申请人需提供申报产品与同品种医疗器械结构特征和关键尺寸对比,可采用结构图、关键尺寸列表和文字描述等方式,尺寸标注可参考YY/T 0809.1标准。需注意YY/T 0809.1标准仅标注了一般性的结构尺寸,注册申请人还需结合产品具体设计提供特征结构和关键尺寸对比,如涂层区域、髋臼杯和内衬锁定设计、股骨柄横截面形状、裙摆设计等。
3.材料性能
注册申请人需对比申报产品和同品种医疗器械各组件的材料牌号及材料性能,并论述生产工艺对材料性能的影响。当申报产品和同品种医疗器械的材料牌号相同,且所用材料均符合相应的国家标准、行业标准或国际标准等公认标准,相应标准中规定了材料性能的接受限值时,申报产品的材料性满足相应标准的要求即可,可不再与同品种医疗器械进行材料性能测试对比,如符合GB/T19701标准要求的超高分子量聚乙烯,符合YY/T0605-9标准的高氮不锈钢,符合GB/T13810标准的TC4、TC4ELI和TC20,符合YY/T0117.3标准的铸造钴铬钼和符合YY/T0605-12标准的锻造钴铬钼等。
对于高交联超高分子量聚乙烯制成的髋臼内衬,对于压缩模量、热性能(结晶度、熔点)、疲劳裂纹扩展、溶胀度、氧化指数、反式亚乙烯指数、自由基浓度、氧化稳定性等材料性能,应开展研究,对研究结果的临床可接受性应有充分的论证,与同品种医疗器械进行对比有助于评估结果临床可接受性。若拉伸性能、抗冲击性能满足GB/T19701标准要求,上述两项性能可不再与同品种医疗器械进行测试对比。
4.产品性能
常规设计的髋关节假体产品性能主要包括股骨柄疲劳性能、髋臼杯抗变形性能、关节面磨损性能、涂层性能、髋臼杯与内衬锁定性能、球头与股骨柄锥连接性能、髋关节假体活动范围等。
(1)股骨柄疲劳性能
股骨柄疲劳性能包括颈部和柄部疲劳性能,建议参照YY0118标准提及的方法开展试验。考虑到相应标准规定了股骨柄疲劳性能的接受限值,申报产品疲劳性能满足标准要求即可,一般不再要求与同品种医疗器械进行测试对比。
(2)髋臼杯抗变形性能
建议参照YY∕T 0809.12标准开展测试,提供申报产品与同品种医疗器械的测试对比。
若申报产品与注册申请人境内已上市的髋关节假体产品相比,髋臼杯设计无任何变化,即原材料、结构尺寸、工艺和质控要求完全相同,可提供相应支持性资料,或髋臼杯设计不会改变抗变形性能或会增强抗变形性能,可提供充分的论证,不需与同品种医疗器械进行测试对比。
(3)磨损性能
注册申请人应提供申报产品髋臼组件与预期配合使用股骨组件形成的关节面的磨损性能资料,并与同品种医疗器械在相同试验方法下的进行磨损性能对比。进行磨损性能对比时,同品种医疗器械的关节面材料与申报产品需尽可能相同;若存在差异,需阐明同品种医疗器械的选择依据。推荐采用YY/T 0651、ISO 14242、ISO 17853等标准中的测试方法和参数。磨损性能的对比建议包括磨损率、磨损量-时间曲线、肉眼和显微镜下磨损试验前后关节面形貌等。若为新型关节面材料,还需对磨屑粒径大小、形貌、生物相容性进行研究。
(4)生物型股骨柄和髋臼杯的涂层性能
生物型股骨柄和髋臼杯常见的涂层材料包括纯钛和钙磷陶瓷等,常见的涂层工艺包括等离子喷涂、烧结和电泳沉积等。不同涂层材料和工艺形成的涂层微观结构、力学性能和骨结合性能不同,因此建议尽可能选择具有相同涂层材料和工艺的产品作为同品种医疗器械。
需对比申报产品与同品种医疗器械的涂层性能和微观结构。涂层性能包括涂层与基体材料间的力学性能(如拉伸强度、动静态剪切强度等)和磨损性能。涂层微观结构主要包括涂层厚度、形貌、粗糙度、孔隙率、平均空隙截距等,具体需对比项目与涂层类型相适应,例如,对于等离子喷涂涂层,应至少包括形貌图、厚度、孔隙率、平均空隙截距等;对于髋臼杯外表面3D打印多孔结构,微观结构至少应包括形貌图、丝径、最小打印单元结构、孔隙率、孔径、孔隙渐变梯度、内部连通性等。考虑到YY0118标准规定了等离子喷涂金属涂层磨损性能的接受限值,申报产品满足标准要求即可,一般不再要求与同品种医疗器械进行测试对比。
若申报产品股骨柄和髋臼杯的涂层与注册申请人境内已上市的髋关节假体相比,基底材料、涂层材料、涂层工艺、及其质控要求均未发生改变,可充分表征申报产品的涂层性能和微观结构,提供涂层未发生变化的支持性资料,不再需要与同品种医疗器械进行测试对比。
(5)髋臼杯与聚乙烯内衬锁定性能
髋臼杯和衬垫通常为机械锁定,需对比申报产品与同品种医疗器械的锁定性能,包括轴向推出试验、撬出试验、旋转分离试验等。
若申报产品与注册申请人境内已上市的髋关节假体产品相比,髋臼杯内衬机械锁定设计无任何变化,即原材料、结构尺寸、工艺和质控要求完全相同,可提供相应支持性资料,不需与同品种医疗器械进行测试对比。
(6)金属球头锥连接性能
若申报产品组件含有锥连接(如球头与股骨柄、模块式股骨柄组件间),需提供申报产品与同品种医疗器械锥连接性能的对比资料,如抗拔出性能、抗扭矩性能等。
若申报产品与注册申请人境内已上市的髋关节假体产品相比,锥连接设计无任何变化,即原材料、结构尺寸、工艺和质控要求完全相同,可提供相应支持性资料,不需与同品种医疗器械进行测试对比。
(7)陶瓷球头与陶瓷内衬组件性能
陶瓷球头需与配合使用的股骨部件进行破碎试验、疲劳试验、疲劳后破碎试验、脱出试验、扭矩试验,陶瓷内衬需与配合使用的髋臼外杯、股骨部件进行破碎试验、疲劳试验、疲劳后破碎试验、压出试验、扭矩试验和撬出试验。注册申请人可将上述试验结果与同品种医疗器械进行比较,也可根据公认的接受限值论述试验结果的可接受性。
(8)活动范围
建议参照YY0118标准提及的方法开展试验。考虑到相应标准规定了活动范围的接受限值,申报产品活动范围满足标准要求即可,一般不再要求与同品种医疗器械进行测试对比
(9)其他
注册申请人需选择各组件最差情形作为测试样品,最差情况指在性能测试中预期表现最差的规格。结构设计差异显著,难以论证最差情况的组件建议分别开展测试。
在与同品种医疗器械进行性能对比时,测试方法和参数应相同,注册申请人应在对比表中列明申报产品与同品种医疗器械的测试方法和结果数据。
若存在相应测试标准,建议采取标准规定的测试方法和参数进行测试,若自行设计测试方法或改变标准中的测试参数,需提供测试方法和参数的合理依据,同时与同品种医疗器械开展测试对比。
(四)论证差异不对安全有效性产生不利影响
1.产品设计和关键尺寸
注册申请人需明确申报产品与同品种医疗器械结构尺寸的相同性和差异性,并论述差异对产品安全有效性的影响。不同的结构尺寸差异对安全有效性的影响不同,评价差异对安全有效性影响的方法亦不相同。
部分结构尺寸差异通过分析可论证其不对安全有效性产生不利影响。例如,近端固定生物型股骨柄在同品种医疗器械基础上增加了远端开槽设计,开槽位置位于远端且长度较小,经过充分分析发现其不影响柄身力学性能,亦不影响股骨柄初始和长期固定稳定性,论证该差异不对申报产品安全有效性产生不利影响。
部分结构尺寸差异需通过力学试验论证其不对安全有效性产生不利影响。例如,锥连接结构尺寸存在差异,若该差异仅影响股骨柄和球头连接性能,此时可开展锥连接与球头连接力学试验,若结果显示申报产品不差于同品种医疗器械,则可证明该结构尺寸差异不对申报产品安全有效性产生不利影响。
部分结构尺寸差异需增加具有相似或相同设计的已上市产品作为同品种医疗器械,以论证其不对安全有效性产生不利影响。例如,若申报产品存在与所选同品种医疗器械不同设计型号时,可增加同品种医疗器械以证明该设计型号的安全有效性。
2.材料性能
若申报产品与同品种医疗器械材料牌号不同,建议增加相同牌号材料同品种医疗器械进行测试对比。
3.产品性能
若申报产品性能优于或与同品种医疗器械相当,可为申报产品与同品种医疗器械具有相同的安全有效提供科学证据。若申报产品部分力学性能低于同品种医疗器械,注册申请人需分析申报产品力学性能较低的原因,可通过对产品进行设计变更以提高产品的力学性能。若注册申请人降低申报产品部分力学性能,以获取其他方面的临床受益,需从临床风险和受益的角度论述力学性能降低后仍可以接受的充分理由及证据,申报产品临床数据可为产品临床风险受益提供证据。
论证涂层微观结构对体内骨整合效果的影响通常较难,若难以论证微观结构差异对骨整合的影响,可考虑增加具有相同涂层的同品种医疗器械,或通过动物试验予以论证。
三、同品种医疗器械的临床数据
建议优先选择具有长期临床安全应用史的产品作为同品种医疗器械。该类产品积累了较多的临床数据,含有较多公开的临床数据,如临床文献和登记数据库数据,亦包括较多的中长期临床数据,其在真实的临床实践环境中的安全有效性较为确切。
髋关节假体同品种医疗器械的临床数据常包括临床文献数据、登记数据库数据、不良事件数据等类型,注册申请人也可通过同品种医疗器械企业授权获取临床试验数据。鼓励使用良好治理的各国关节数据登记数据库中的数据,相较于其他类型数据,该数据具有人群覆盖面大、随访时间长等优势,可用于评价髋关节假体系统的中远期安全有效性。登记数据库数据呈现注意明确不同时间点的累计翻修率及其95%置信区间、假体植入例数、翻修例数、累计观察年、最短最长观察年等。
考虑到髋关节假体数据来源的多样性,建议注册申请人提取关键要素,以图表形式呈现数据,以附件的形式提供数据来源的原文件和/或原文。
(一)有效性数据
对于髋关节假体,有效性临床数据可参考以下关键要素提取数据:
1.患者信息:性别、年龄、诊断、骨质情况、伴随疾病以及其他影响临床结局的特征等;
2.产品信息:产品名称、型号规格;
3.研究设计:设计类型、样本量、研究证据等级;
4.评价指标:提取各时间点(包括术前、术后各随访点)评价指标数据,包括但不限于生存率或翻修率、功能性评分、活动范围和生活质量评分等。相关的功能性评分包括Harris评分、Oxford评分、Charnley评分、HHS评分、Merle D’Aubigne评分、VAS评分、SF-36/SF-12评分、HOOS评分、Q-5D评分、牛津评分、WOMAC评分、UCLA活动评分等。
如上所述,髋关节假体产品有效性评价指标种类较多,在收集和分析同品种医疗器械有效性数据时,应分别对各评价指标数据进行汇总分析,适用时开展荟萃分析。
(二)安全性数据
常见的髋关节假体不良事件包括脱位、假体周围骨折、松动、骨溶解、感染、下肢不等长、大腿疼、粗隆不愈合、活动范围受限等。髋关节假体安全性数据常来源于各国不良事件数据库、召回数据库和临床文献,不良事件数据库包括各国药监局的不良事件数据库、企业自身的不良事件数据库、医院的不良事件数据库和第三方商业公司或协会组织运行的不良事件数据库。针对不良事件,应以表格的形式提供各国上市时间、销售数量(如可获取)、不良事件类别及数量、与产品相关性、事件描述、原因分析、处理方式和处理结果等具体信息。
附录:可参考的指导原则
1 |
《医疗器械临床评价技术指导原则》(2021年第73号通告) |
2 |
《医疗器械临床评价等同性论证技术指导原则》(2021年第73号通告) |
3 |
《医疗器械注册申报临床评价报告技术指导原则》(2021年第73号通告) |
4 |
《髋关节假体系统注册技术审查指导原则》(2017年第23号通告) |











