今日,浙江省发布了二类医疗器械电子申报操作手册,详细说明了二类医疗器械电子申报流程,详情如下:
一、 受理通知书、行政审批省局缴费通知书下载
第二类医疗器械首次注册、第二类医疗器械变更注册、第二类医疗器械延续注册事项申请,在受理中心受理资料之后会相应生成《受理通知书》《行政审批缴费通知书》,各企业可通过接收到的受理或缴费短信通知内的网址登录系统查看下载。
使用chrome或360安全浏览器等浏览器急速模式,打开系统网址(http://qcwb.zjfda.gov.cn/)。

使用原浙江省药品监督管理局行政审批系统的账号密码登录,全程网办系统不需要使用UKey识别账号登录,可直接输入账号以及密码登录系统。大多数企业账号为SQ或JQ开头的,如SQ33000001。若使用原密码登录提示密码错误的,可将账号作为密码尝试是否能登入系统,如账号:SQ33000001,密码:SQ33000001。如果还是登录不了系统,可电话0571-88903259,或qq1611607245、3148183981联系查询账号密码。
登入系统后界面如下:
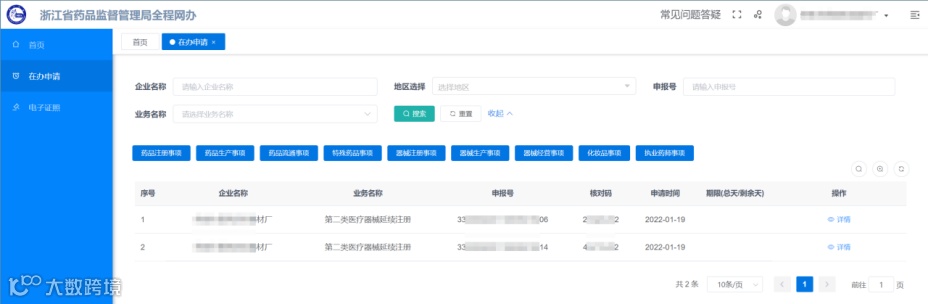
点击左侧菜单【在办申请】进入查看当前申报的办件,列表会展示当前正在办理的所有企业申请,通过点击详情进入查看。

点击“查看”按钮进入办件详情页,在此界面就可查看/下载相应的受理通知书或者缴费通知书。
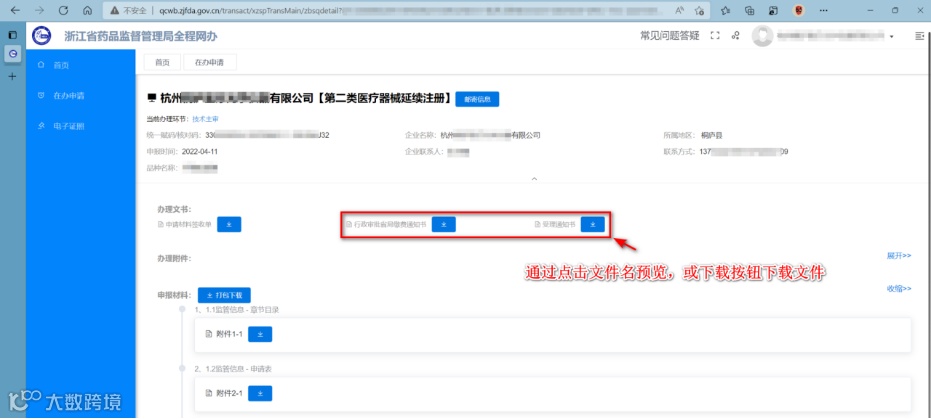
二、 技术审评一次性告知书下载,及资料补正
当主审对办件进行技术审评发补后,企业需登录系统提交相应的补正材料。如何登录与第一点操作方式一致。登录系统后同样在【在办申请】菜单进行操作。

通过点击“详情”按钮进入查看或下载《技术审评一次性告知书》。

补正材料准备好之后,可登录系统在【在办申请】菜单,通过点击“补正材料”按钮进入材料提交页,通过点击各目录右侧“补正”按钮提交相应文件材料,待材料全部上传完成后,点击页面下方“提交预审查”按钮将电子资料上报给主审。
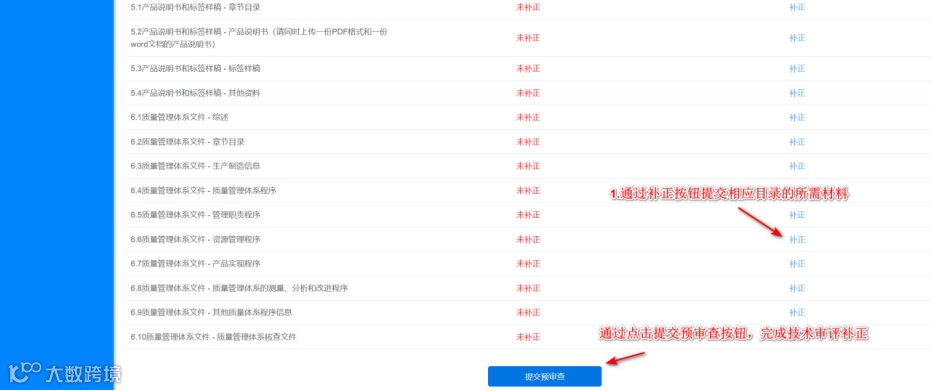
资料提交后办件如图所示,“补正材料”按钮消息,证明资料已经提交。