为进一步规范血液透析浓缩物等8项医疗器械的管理,国家药监局器审中心组织制修订了8项注册审查指导原则。
血液透析浓缩物注册审查指导原则(2023年修订版)
血液透析器注册技术审查指导原则(2023年修订版)
一次性使用血液分离器具注册审查指导原则(2023年修订版)
一次性使用输注器具产品注册审查指导原则(2023年修订版)
一次性使用避光输液器注册审查指导原则(2023年修订版)
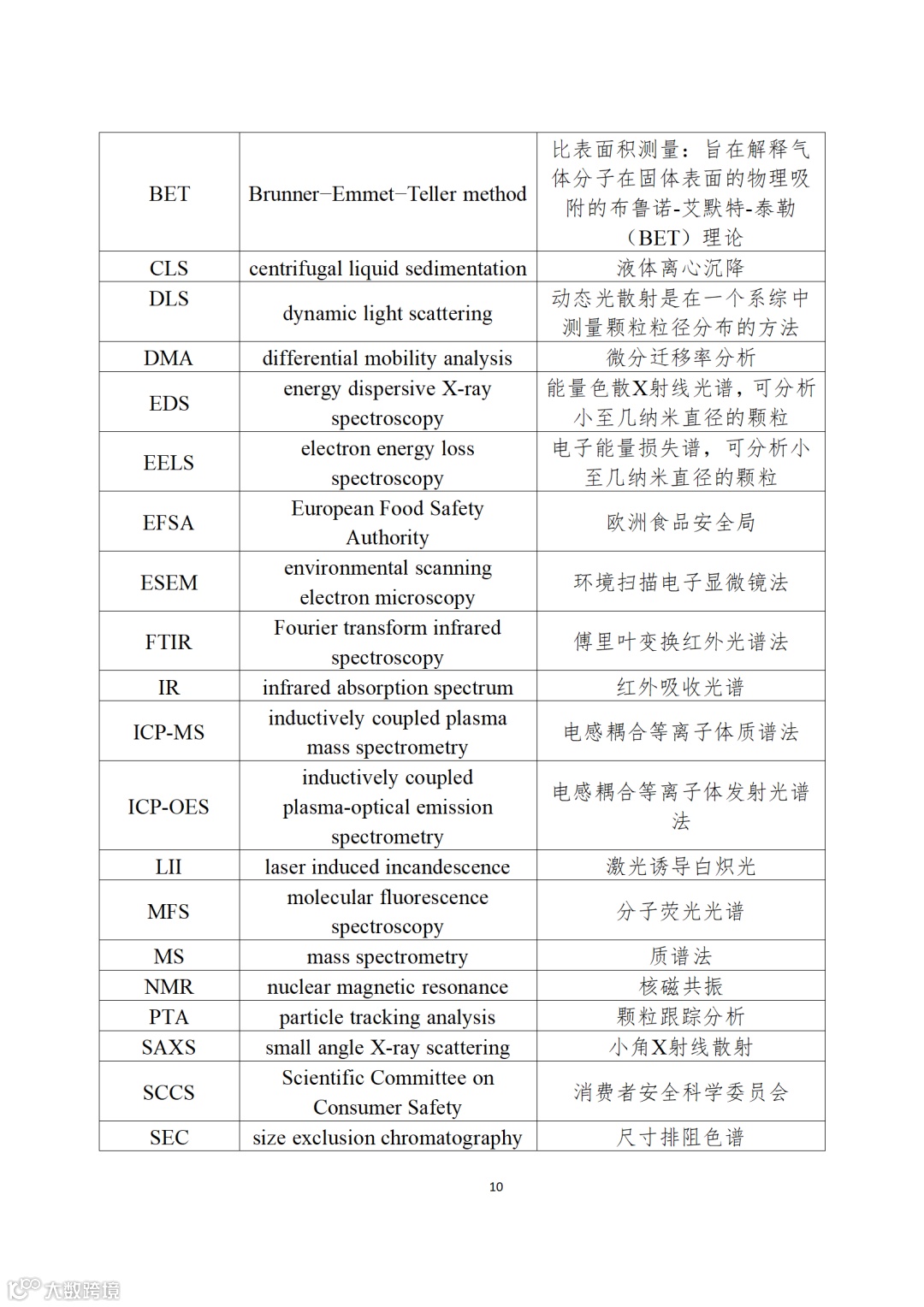
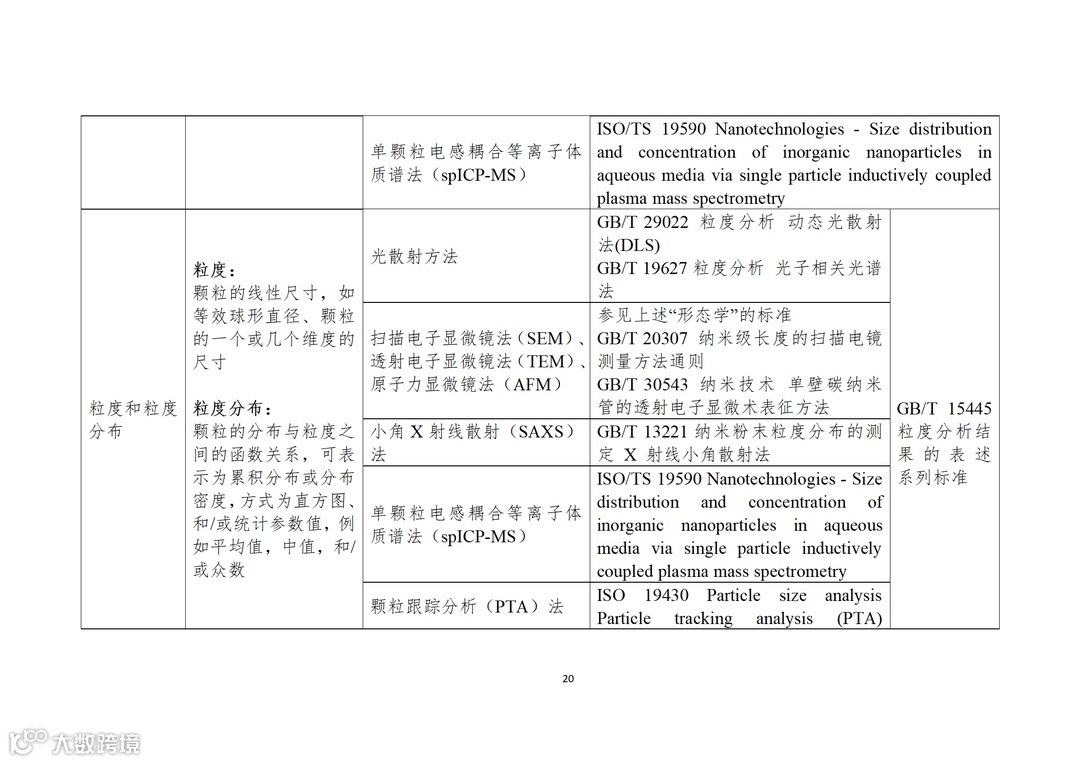
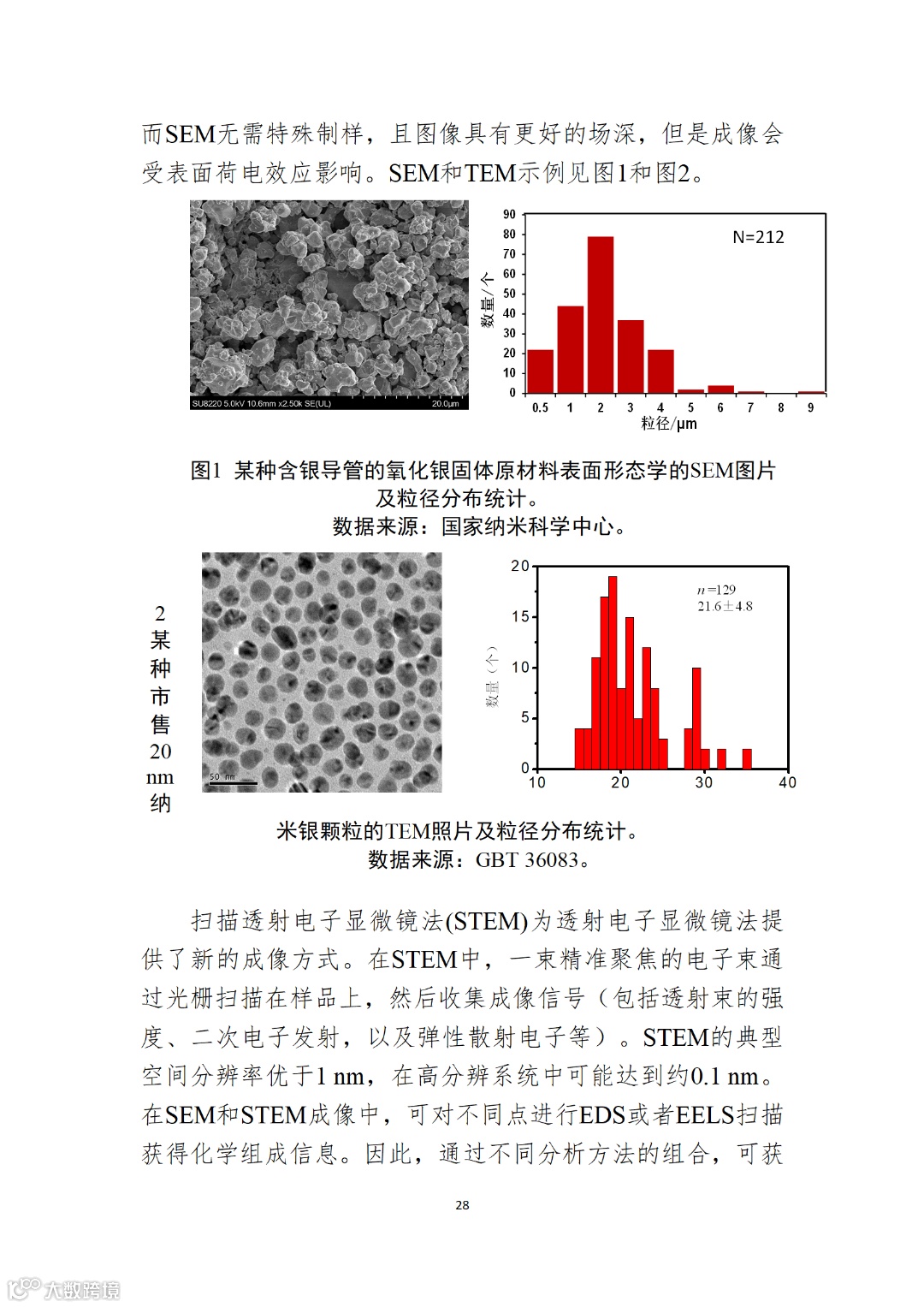
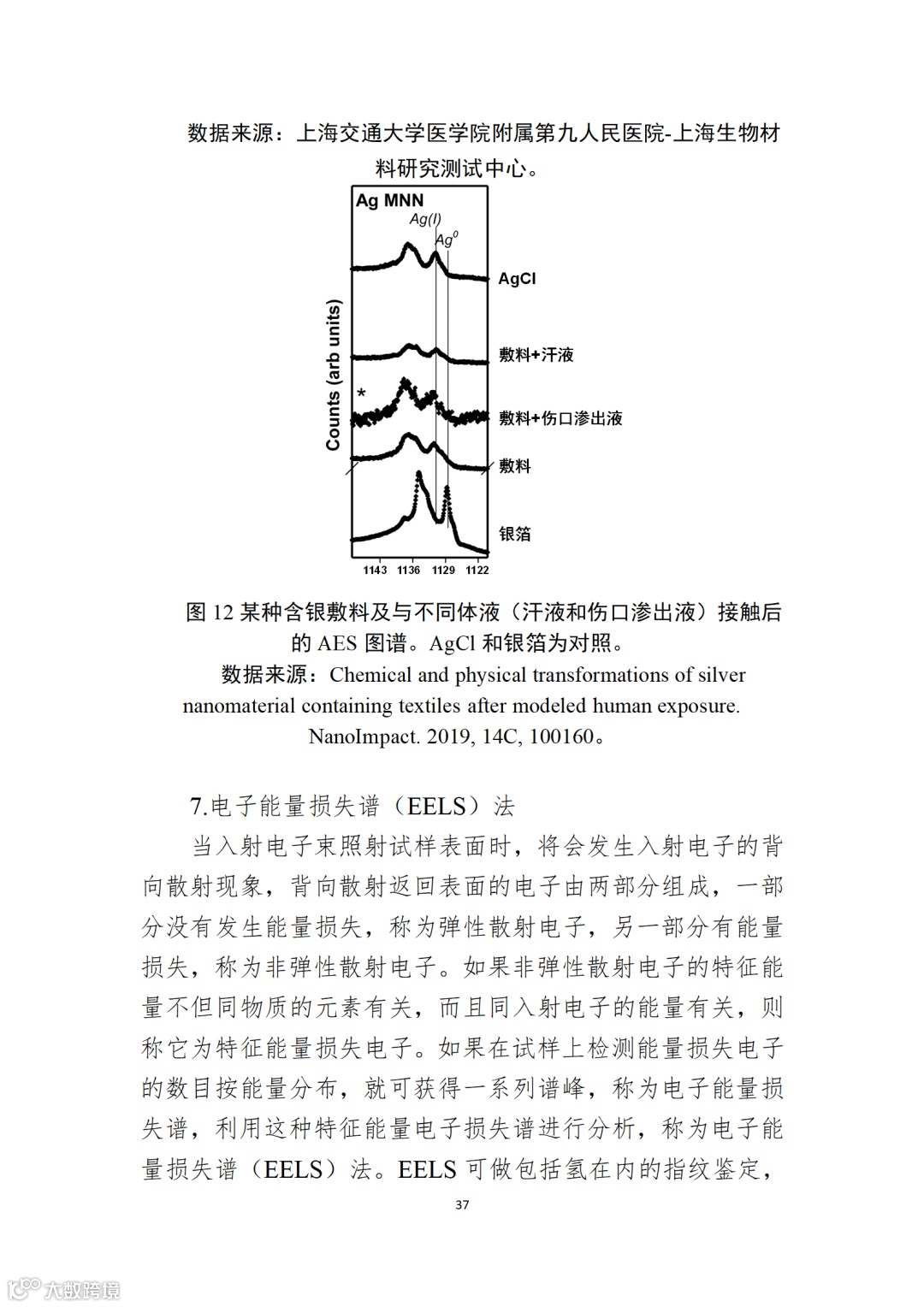
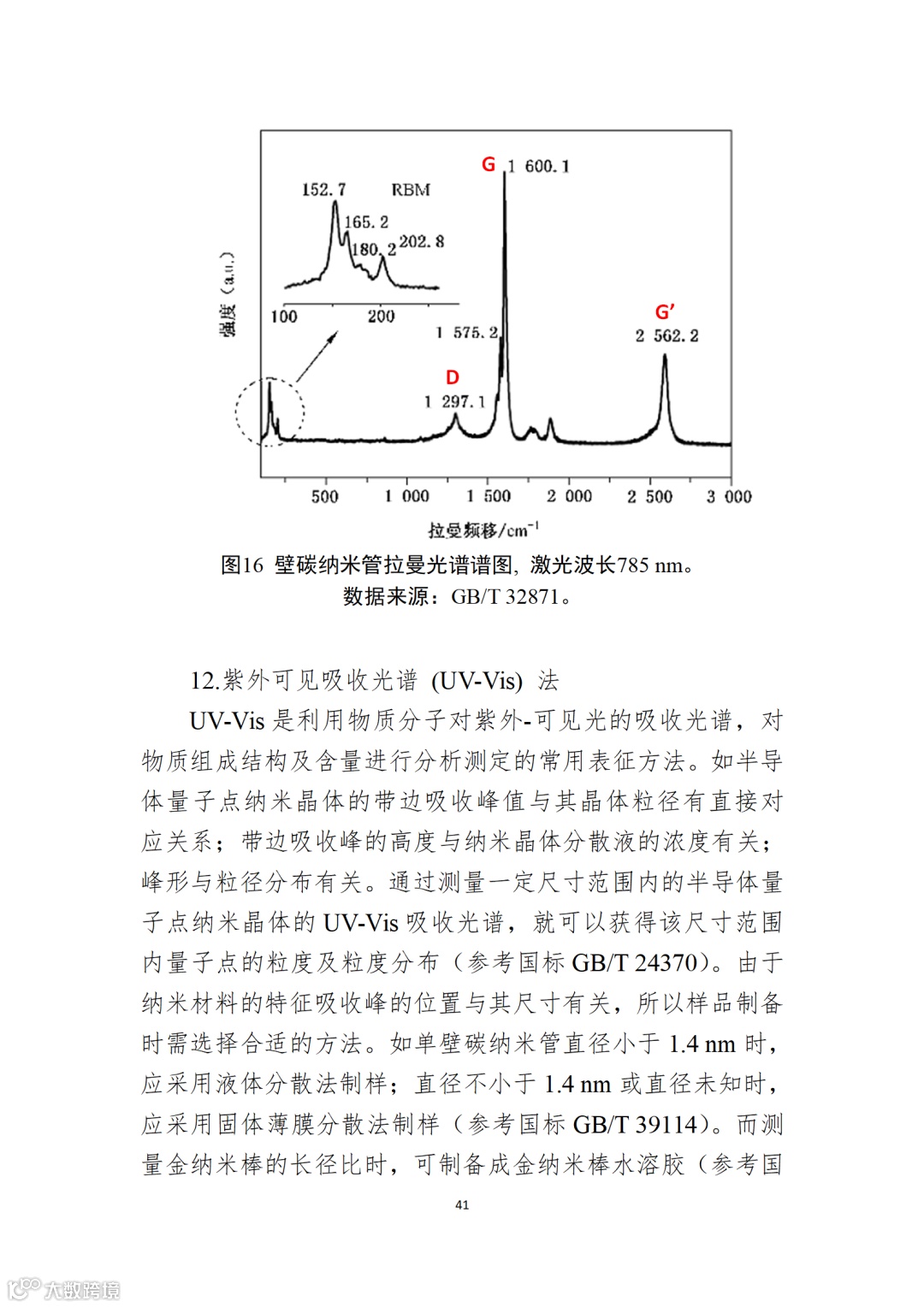
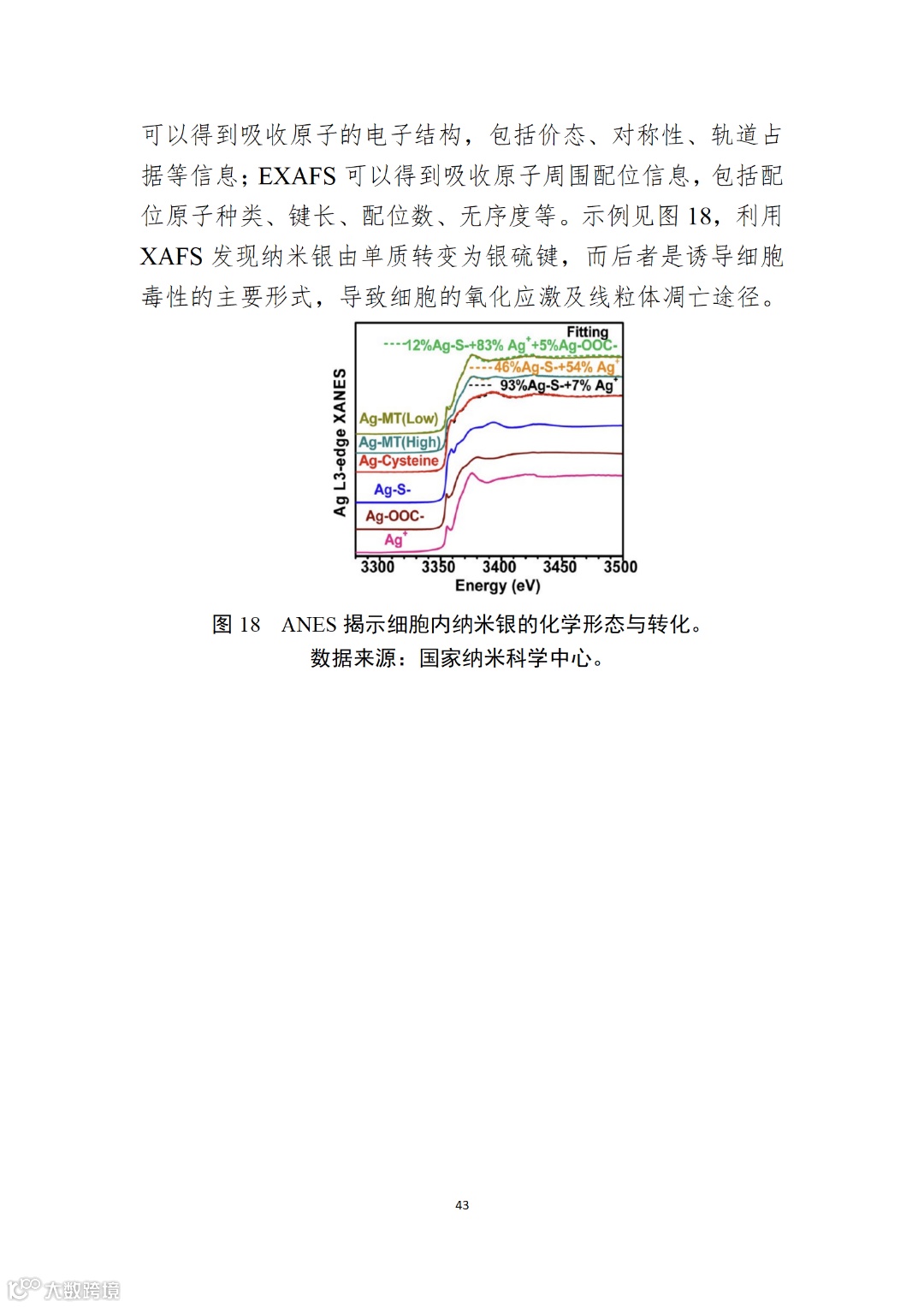
应用纳米材料的医疗器械安全性和有效性评价指导原则 第二部分:理化表征
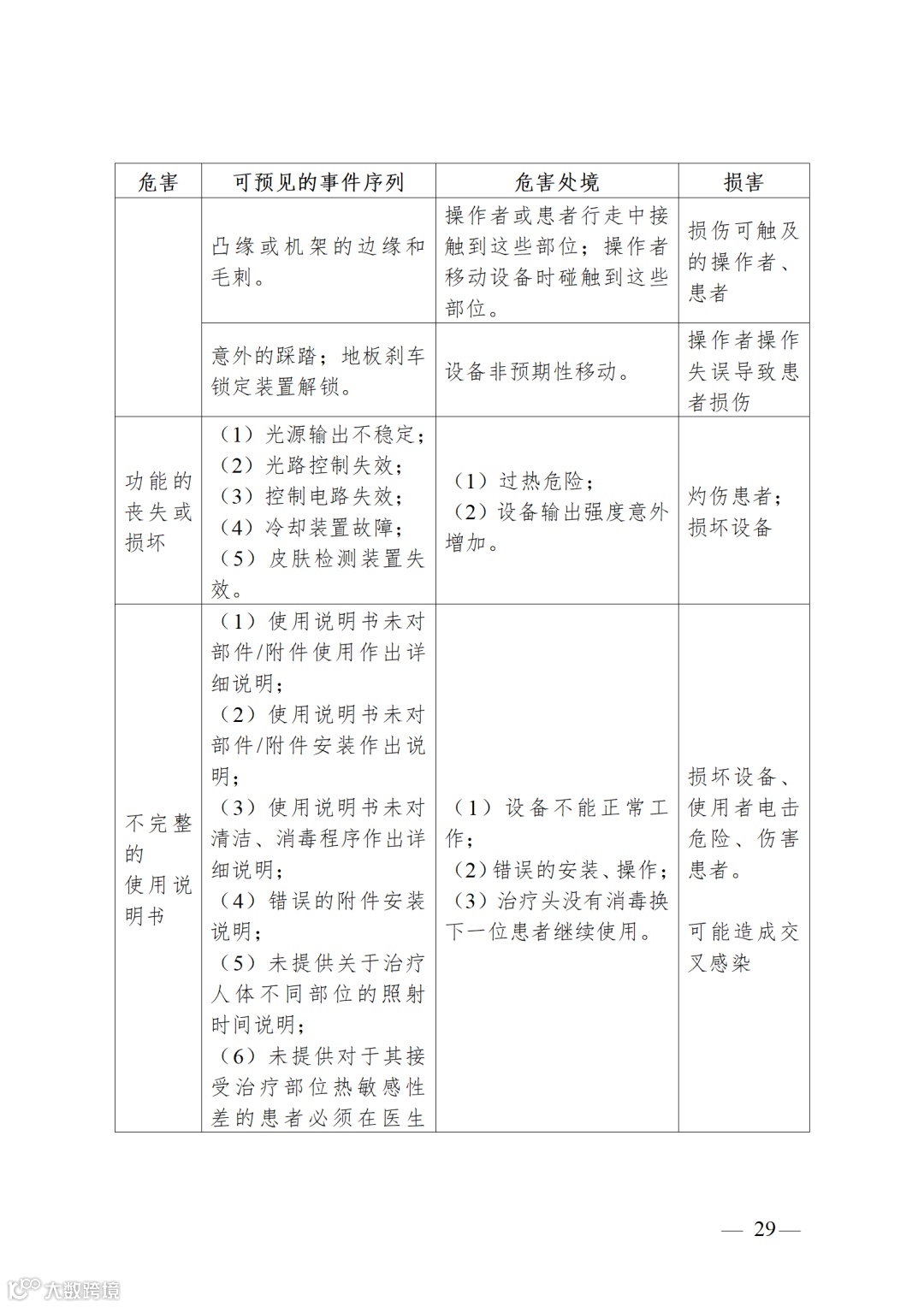
强脉冲光治疗设备注册审查指导原则(2023年修订版)
眼科光学测量设备注册审查指导原则
血液透析浓缩物注册审查指导原则
(2023年修订版)
(点击可查看大图)












血液透析器注册技术审查指导原则
(2023年修订版)














一次性使用血液分离器具注册审查指导原则
(2023年修订版)













一次性使用输注器具产品注册审查指导原则
(2023年修订版)





















一次性使用避光输液器注册审查指导原则
(2023年修订版)




















































强脉冲光治疗设备注册审查指导原则
(2023年修订版)