PPT和视频主要内容汇总:
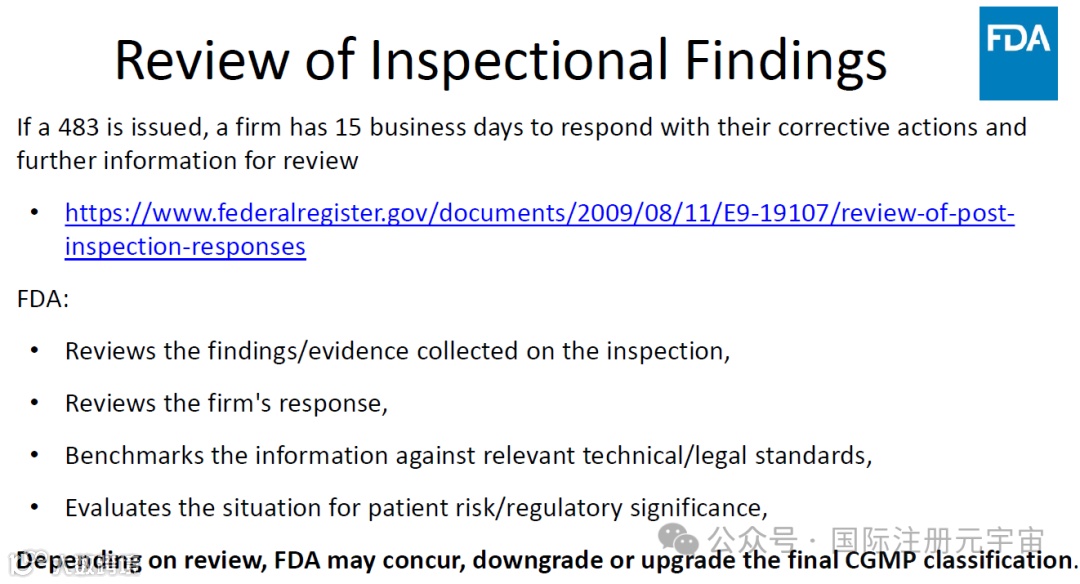
1. 对检查结果的审查
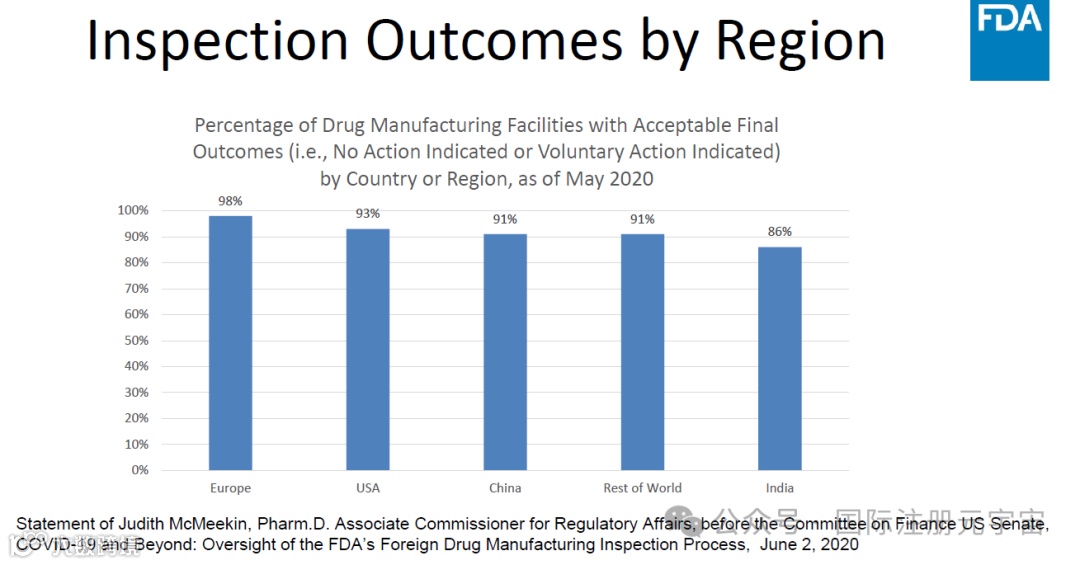
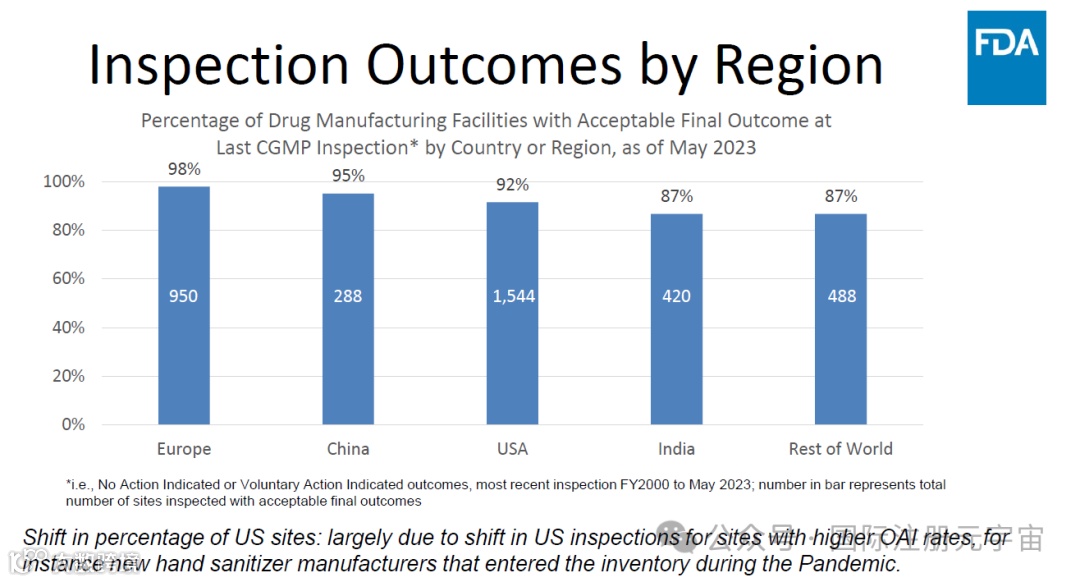
2. 3类检查结果分类:NAI, VAI,OAI
3. 三类检查结果的解释
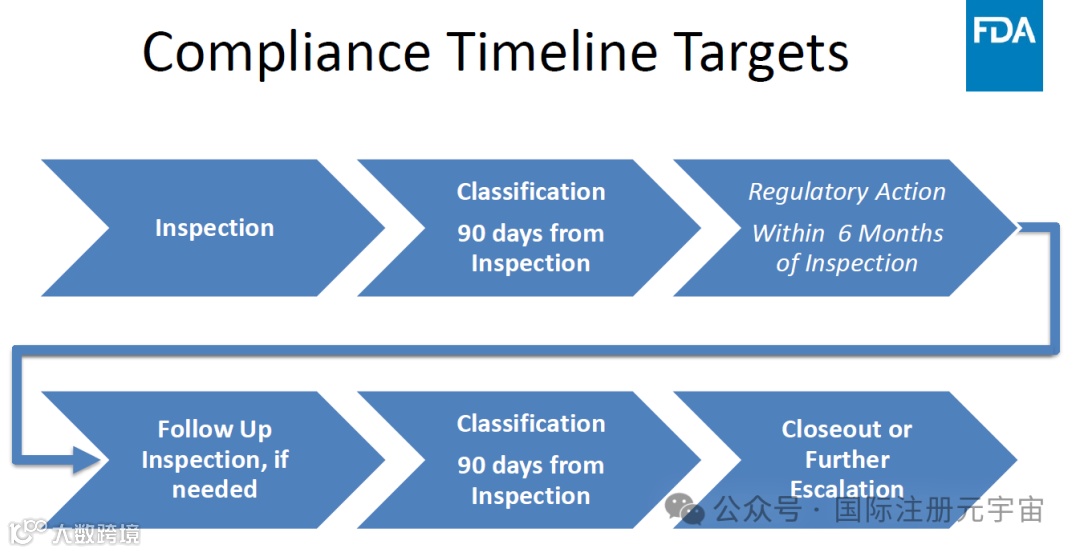
4. Compliance Timeline Target
5. FDA的监管 行动:compliance toolbox, 对FDA行动的认识(解释warning letter),import alert 解除等
视频请链接:








往期文章导航
各国/地区注册
新药
FDA暂缓批准一新药指南分享:美国I期、II期和III期的CMC内容和格式要求
API
仿制药
指南学习:FDA 和ANDA 申请人之间的post-CRL 澄清电话会议(总结版)
FDA其他
西林瓶和瓶塞的特性变更举例(化药新药和仿药适用)-2024年FDA
FDA变更: 最新包材变更评估和申报建议(注射剂,仿药和新药)
EMA
GMP
最新资讯
EMA变更指南将有更新:自 2025年1 月1日起采用修订的变更法规指南
25个FDA药品相关指南更新(新药,仿药,兽药等),2024-07-25~2024-10-12
Novartis Kisqali® 获得欧盟批准,用于复发风险高的HR+/HER2- 早期乳腺癌患者群体
声明:原创文章,未经国际注册元宇宙公众号授权,禁止得以任何形式转载、摘编、复制、截图等,如需获得授权,请后台私信或联系:3852455633@qq.com。转载、复制或截图,不得用作商业用途。


