美国食品和药物管理局(FDA认证)是医疗器械领域的监管机构,允许制造商在准备和评估医疗器械上市前申报时使用国家和国际自愿性共识标准。
FDA强调自愿性共识标准对于简化上市前审查和提高其可预测性的重要性。
共识标准被用于对与医疗器械安全性和有效性评估的特定方面提供了共识方法,包括:测试方法、验收标准、风险管理和可用性。
除上述规定外,共识标准的实施是监管方法国际协调的一部分,这使外国医疗器械制造商更容易进入美国市场。
2024年6月24日,FDA发布一份共识标准更新清单List 062,其中包含FDA对其认可用于上市前审查的标准清单所做的修改。在本共识标准更新后,制造商进行医疗器械测试后需满足相关要求。
FDA宣布增加、撤回、更正和修订其认可的某些用于上市前提交和器械其他要求的共识标准。
(2)纠正FDA在列出先前公认的标准时所犯的错误;
(3)对描述标准适用性修订的公认标准的补充信息表的更改。
在表2中,FDA提供了新条目和共识标准清单的清单,这些清单是对认可清单编号:062下公认标准清单的修改。这些条目是FDA以前不认可的标准,具体信息如下:
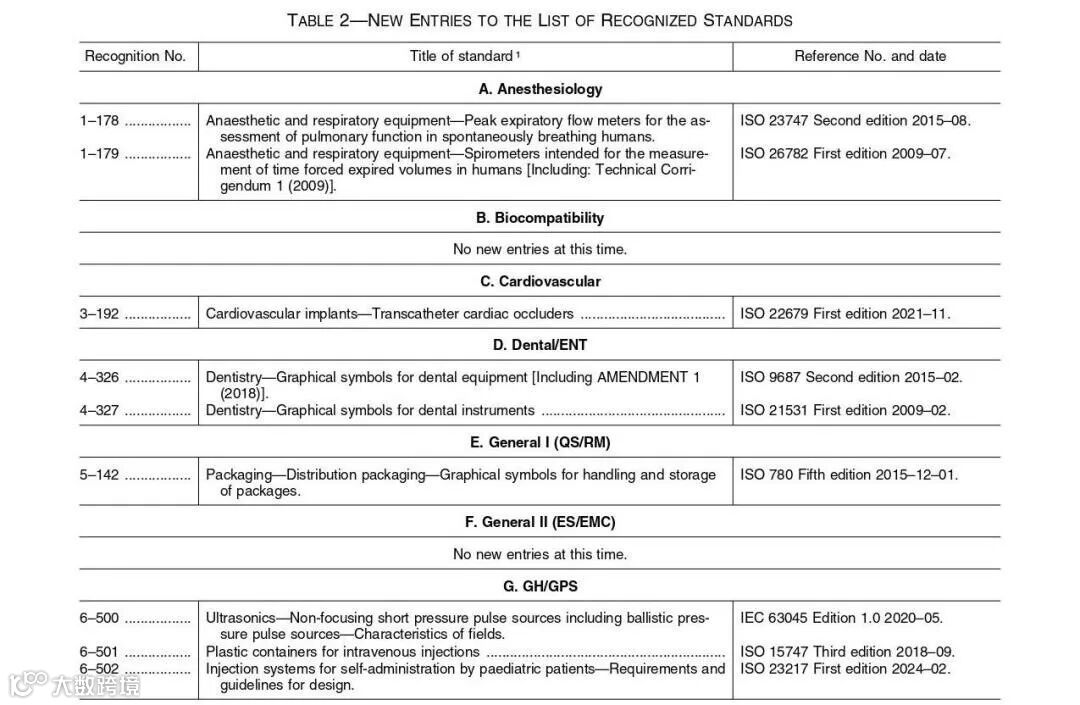
为了帮助制造商查询目前最新的共识标准,FDA给出了共识标准数据库的查询网站,具体链接如下:
https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfStandards/search.cfm














 众信博达
众信博达












