目前公司的研发管线拥有20多个药物开发项目,其中10个抗体处于临床阶段,6个双特异性抗体及4个抗体获得FDA的IND批准。其中靶向PD-1/CTLA-4的双抗药物AK104和PD-1单抗药物penpulimab(AK105)已进入到了II/III期关键性临床试验阶段,是公司当前开发进度最快的两款药物。

在这两款核心药物中,最亮眼的莫过于双抗药物AK104。
据了解,一个新型双抗药物的临床开发成功率与生物创新药开发成功率相近(或<20%)。因此与单抗赛道百舸争流不同,截至目前,全球仅有3款双抗药物获批上市,分别为Trion的Catumaxomab、安进的Blinatumomab和罗氏的Emicizumab。
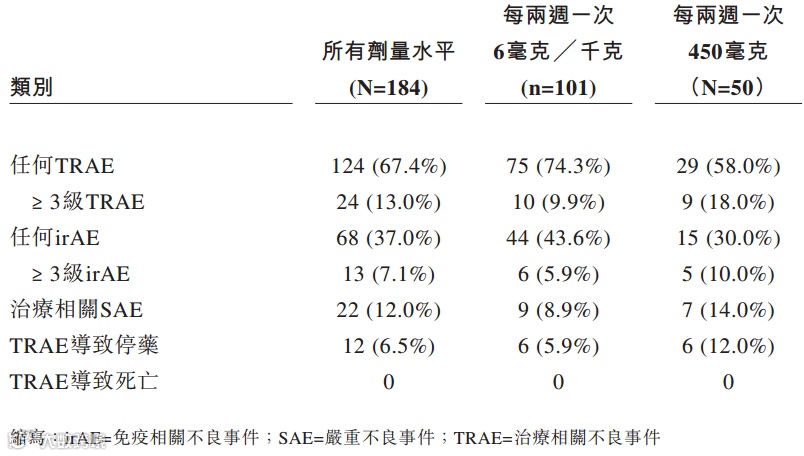
从AK104的Ib/II期临床试验结果来看,相对纳武单抗和伊匹单抗联合疗法,AK104在药物安全性上表现更加优异,因毒性不耐受导致的停药概率远低于参照药物。
在肿瘤免疫治疗方面,康方生物研发的双特异性抗体市场潜力巨大,预计到2025年,双特异性抗体研发管线的增长速度可达到常规单抗药物的三倍。随着全新双特异性抗体进入市场,同时已上市双特异性抗体获批更多适应症,全球市场规模预计在2025年达到80亿美元。
目前,国内在研进入临床试验阶段的PD-(L)1双抗药物仅有康方生物的AK104和康宁杰瑞(09966.HK)的KN046进入ii期临床阶段。可见,在抢占双抗研发赛道的过程中,康方生物已走到国内前列。
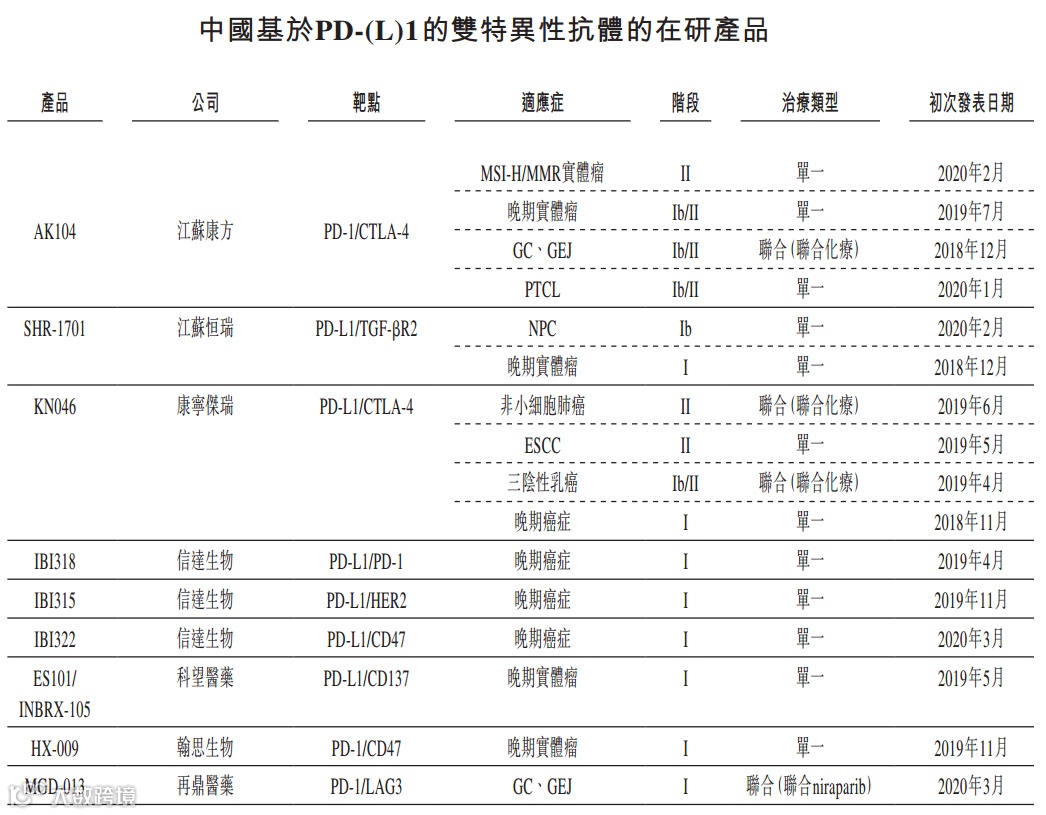
从研发进度和产品安全性角度来看,康方生物的AK104都体现出了一定的先发优势,然而这款药尚处在II期临床阶段,研发风险依然较大,且公司预计其提交新药申请最早也要到2021年下半年,在短时间内公司并不能指望AK104为其带来盈利。
与单一疗法相比,同时使用PD-1和CTLA-4抗体的联合疗法可获得更佳效果。然而,使用PD-1和CTLA-4抗体联合疗法出现严重不良事件( SAE)的比率更高。
所以变现的责任自然落到了其PD-1药物AK105身上。然而在国内一片“红海”的PD-1赛道,要想出人头地并不容易。
截至最后实际可行日期,中国共有六种获批准的PD-1抗体疗法、11种PD-1抗体处于II期临床试验或更后期开发阶段,以及89种在中国评估PD-1抗体的III期临床试验。
数据显示,国内PD-1市场规模虽然在2030年预计达到200亿美元,但在2020年其市场规模仅约20亿美元,。


自成立以来,我们极具远见地开发出一个端对端平台,称为康方全方位探索平台(「 ACE平台」)。我们的ACE平台涵盖全方位的现代生物药发现及开发能力和工艺,且如下图所示,有助我们能在极少依赖外部供应商的情况下营运。这些内部能力在组合为五个主要功能:(1)药物发现、(2)工艺开发、(3)临床前开发、(4)GMP合规生产及(5)临床开发。

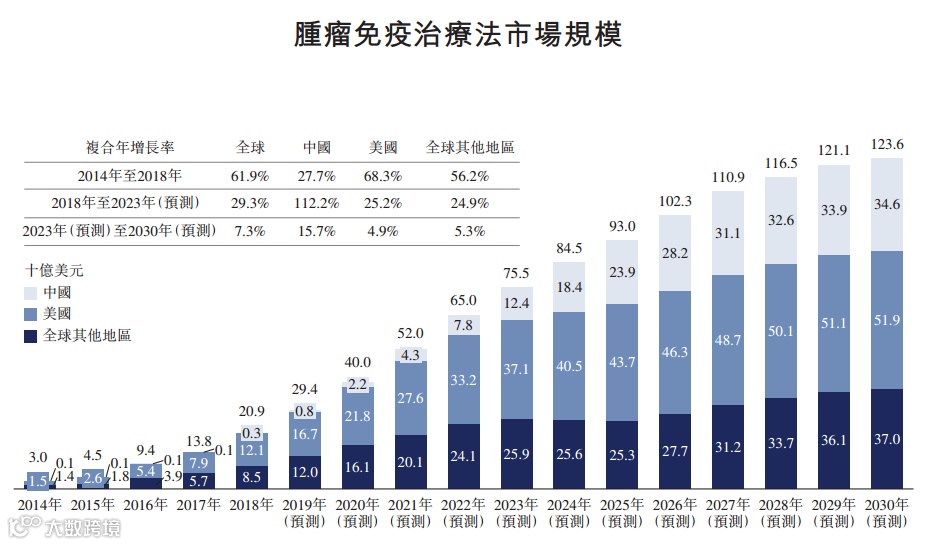
近年来,全球及中国生物制剂市场呈快速增长,肿瘤免疫市场的增速更是惊人。2018年全球的市场规模为209亿美元,预计2030年增长至1236亿美元。

在肿瘤免疫治疗方面,康方生物研发的双特异性抗体市场潜力巨大,预计到2025年,双特异性抗体研发管线的增长速度可达到常规单抗药物的三倍。随着全新双特异性抗体进入市场,同时已上市双特异性抗体获批更多适应症,全球市场规模预计在2025年达到80亿美元。






















