1 专业的医疗器械临床服务提供商
2 从设计到统计一站式技术服务商
3 网络化临床试验技术服务提供商
湖南省药品监督管理局关于办理医疗器械生产产品品种报告事项的通知(湘药监函〔2022〕51号)
各医疗器械生产企业、注册人:
为进一步推进放管服改革,为行政相对人提供便利服务,规范医疗器械产品品种报告事项管理,根据《医疗器械生产监督管理办法》(国家市场监督管理总局令第53号)有关规定,结合我省实际,现就我省医疗器械生产企业报告生产产品品种情况有关要求通知如下:
一、医疗器械生产企业增加生产产品品种但未涉及生产范围变化的,应当在正式生产前向省局提交《湖南省医疗器械生产企业新增生产品种报告表》(附件1),并提交相关说明材料。
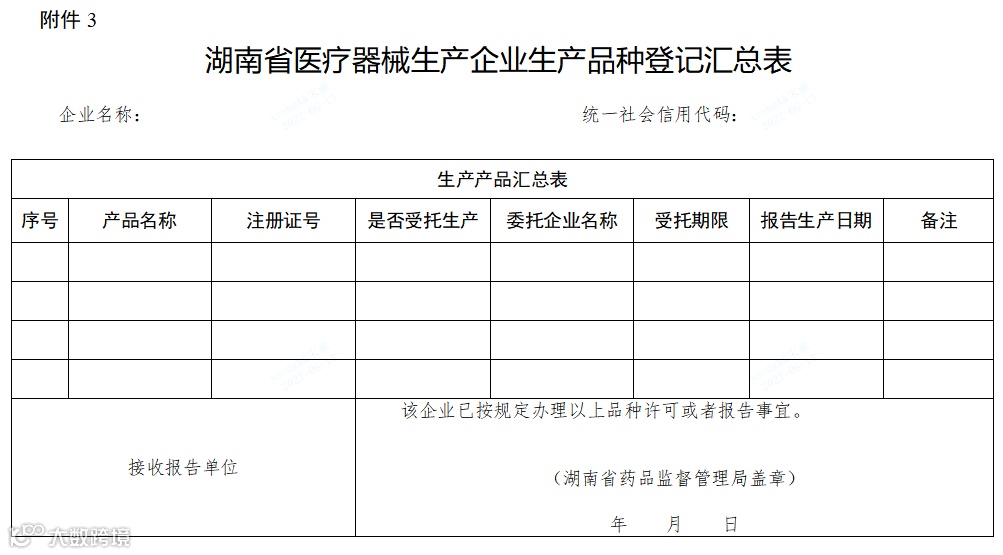
省局接到以上报告事项后,即时向企业出具《湖南省医疗器械生产企业新增生产品种登记表》(附件2),载明相关报告事项。根据企业需要,向企业出具《湖南省医疗器械生产企业生产品种登记汇总表》(附件3)
二、医疗器械生产企业首次生产产品,以及增加生产产品品种并且涉及生产范围变化的,按照生产许可相关要求办理,无需再单独报告。在完成生产许可证核发或者生产范围变更后,根据企业需要,省局及时向企业出具《湖南省医疗器械生产企业新增生产品种登记表》或者《湖南省医疗器械生产企业生产品种登记汇总表》。
三、我省医疗器械生产企业接受外省委托生产的,或者我省注册人委托外省生产的,省局医疗器械监管处接到报告事项后,应按照《国家药监局综合司关于加强医疗器械跨区域委托生产协同监管工作的意见》(药监综械管〔2022〕21号)相关规定,先通报外省注册人或者外省受托生产企业所在地省级药品监督管理局商量协同监管意见。
四、为加强医用口罩、医用防护服、红外体温计等疫情防控产品质量安全监管,我省不鼓励该类产品委托生产。我省在2022年6月1日前取得产品注册证尚未办理生产许可的产品,以及原外省来湘注册并承诺在湖南生产的产品,我省不鼓励委托外省生产。
五、推进信息化建设进程,尽快在湖南省医疗器械生产注册监管信息系统中开设生产品种报告模块,届时可通过网上办理相关报告事项。该模块正式启用前,由相关医疗器械生产企业向省局医疗器械监管处递交报告事项纸质资料。
湖南省药品监督管理局
2022年6月9日
(公开属性:主动公开)
附件点击“阅读原文”下载
附件1:湖南省医疗器械生产企业新增生产品种报告表.doc
附件2:湖南省医疗器械生产企业新增生产品种登记表.doc
附件3:湖南省医疗器械生产企业生产品种登记汇总表.doc


【临床试验软件管理系统:β-CTMS】
欢迎新老朋友体验、使用西格玛医学基于SaaS(Software-as-a-service,软件即服务)模式的β-临床试验管理系统,该系统面向企业(申办方)、医院(研究方)等行业组织,同时也面向PM、CRA、CRC等行业从业人员,做好大家临床试验的得力助手。
【医疗器械产品查询数据库】
欢迎新老朋友体验、使用西格玛医学开发的单维度、多维度、复合维度查询产品器械产品;全生命周期的产品信息展示/智能化同类产品比对/高水平的认领互动;全面的企业产品追踪/智能延续注册提醒,该系统面向企业(申办方)、医院(研究方)等行业组织,同时也面向PM、CRA、CRC等行业从业人员,做好大家临床试验的得力助手。

长按识别二维码 添加西格玛医学
获取更多器械资源

南京西格玛医学(证券代码:873450)是创新型医疗器械CRO,提供医疗器械临床研究、方案撰写、临床监查、数据管理、统计分析、器械SMO、受试者招募、第三方稽查等临床试验专项服务和器械产品注册体系的整体解决方案。









