关注我们 | 了解医疗器械最新资讯

西格玛医学
1 专业的医疗器械临床服务提供商
2 从设计到统计一站式技术服务商
3 网络化临床试验技术服务提供商
一、申请人名称
无锡蕾明视康科技有限公司
二、申请人住所
无锡市楝泽路29号科教软件园17号1楼
三、生产地址
无锡市科教软件园23号楼1楼,无锡市楝泽路29号科教软件园17号1楼-2楼
技术审评概述
一、产品概述
该产品为一件式、可折叠、后房型人工晶状体, 主体和支撑部分均为疏水性丙烯酸酯材料,其中添加了染色剂,而后经增色剂处理;光焦度范围0D~34D,以0.5D递增;光学设计为单焦、非球面,襻型为L型。该产品以无菌状态提供,一次性使用。货架有效期5年。
成年白内障患者无晶体眼的视力矫正。
型号:FS60A、FS57A、FS55A。
规格:光焦度0D~34D,以0.5D为间隔。
产品是由光学主体和支撑部分(襻)组成的光学镜片,它的工作原理是通过临床白内障摘除手术超声乳化去除人眼内已浑浊的天然晶状体,再将产品植入人眼囊袋内, 以替代人眼天然晶状体;其基于透镜的光学原理, 通过光学区获取需要的聚焦能力,从而恢复患者视力。
产品使用了染色剂和增色剂共同作用来调节蓝光滤过量。染色剂能吸收蓝光, 增色剂能使人工晶状体在阳光或紫外照射条件下实现光致增色。产品在暗环境下为浅黄色, 在亮环境下增色至深黄色;回到暗环境下,晶状体则还原为浅黄色。
二、临床前研究概述
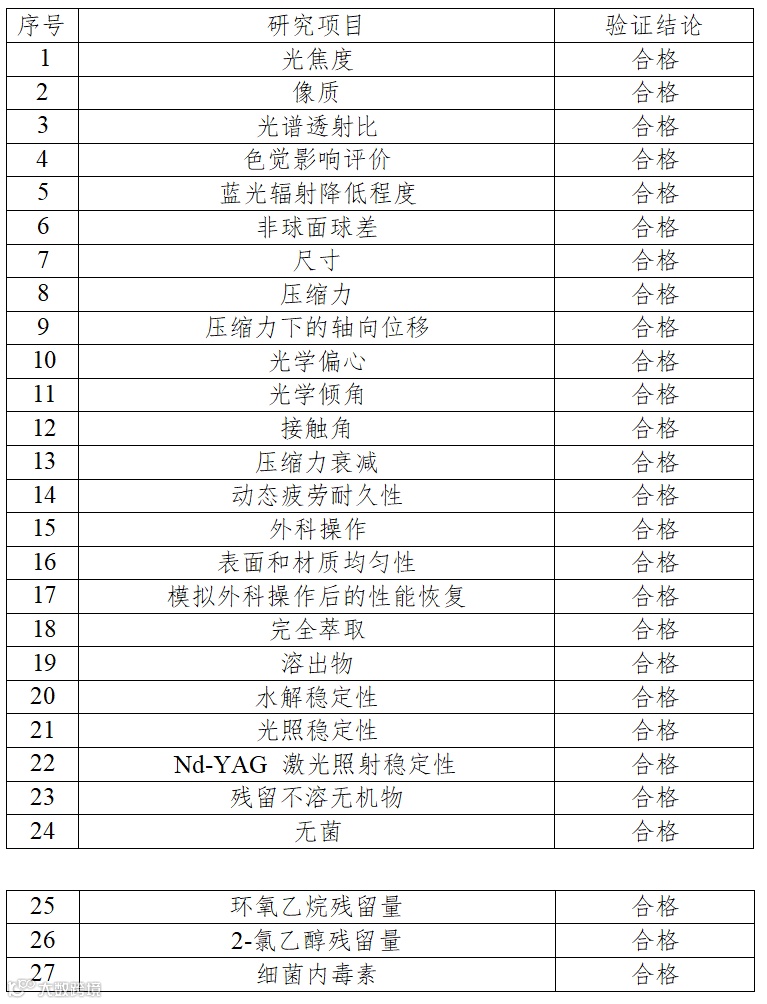
1.产品技术要求研究
产品技术要求研究项目如表1 所示。
表1 产品技术要求研究项目摘要
2.设计验证
申请人开展了设计验证, 验证项目包括:
光学性能:光焦度、像质、光谱透射比、色觉影响评价、蓝光辐射降低程度、非球面球差、增色及还原时间、增色状态下的光谱透射比、增色状态下的像质、增色状态下的蓝光辐射降低程度。
机械性能:尺寸、压缩力、压缩力下的轴向位移、光学偏心、光学倾角、接触角、压缩力衰减、动态疲劳耐久性、外科操作、表面和材质均匀性。
理化性能:完全萃取、溶出物、水解稳定性、光照稳定性、Nd-YAG激光照射稳定性、残留不溶无机物、模拟使用条件下稳定性、增色反应衰减和失效、无菌、细菌内毒素、环氧乙烷残留量、2-氯乙醇残留量等研究。
性能研究资料表明产品符合设计输入的要求。
依据YY0290.5和GB/T 16886系列标准的要求开展了生物学评价,包括:细胞毒性试验、迟发型超敏反应试验、遗传毒性、植入后局部反应试验、眼内植入试验、急性全身毒性试验、亚慢性全身毒性试验。生物学风险可接受。
该产品采用环氧乙烷灭菌,以灭菌状态提供。申请人提供了环氧乙烷灭菌确认报告,支持所采用灭菌工艺可达10-6无菌保证水平。
该产品货架有效期为5年。申请人提供了货架有效期验证报告,包括产品稳定性验证、包装完整性验证和运输稳定性验证。
申请人通过临床试验路径进行临床评价。临床试验设计为前瞻性、多中心、随机、开放、阳性平行对照临床试验,对照组为美国爱尔康公司生产的AcrySofIQ人工晶状体疏水性丙烯酸酯产品, 非劣效界值为-10%;最终纳入FAS有175 例,其中试验组86例, 对照组89例;纳入PPS有167例,其中试验组82例,对照组85例;纳入SS有175例,其中试验组86例,对照组89例。
主要评价指标为术后6 个月的最佳矫正远视力达到20/40的百分比。FAS集试验组受试者术后6个月的最佳矫正远视力达到20/40 的百分比为100%;对照组受试者术后6个月的最佳矫正远视力达到20/40的百分比为96.63%;试验组与对照组“术后6个月的最佳矫正远视力达到20/40的百分比”的差值为3.37%,其95%置信区间为(-0.38%,7.12%),p<0.001,置信区间下限大于-10%。PPS集试验组与对照组“术后6个月的最佳矫正远视力达到20/40 的百分比”的差值为2.35%,其95%置信区间为(-0.87%,5.58%),p<0.001,置信区间下限大于-10%,申报产品的“术后6个月的最佳矫正远视力达到20/40的百分比”非劣于对照产品。
次要评价指标结果显示,FAS中试验组和对照组受试者术后1天、1周、1个月、3个月、6个月、12个月的最佳矫正远视力、裸眼远视力, 两组间术后各时点的最佳矫正远视力得到改善,且均维持在1.0左右,组间差异无统计学意义;试验组受试者术后3个月的对比敏感度和对照组受试者术后3 个月的对比敏感度的差异无统计学意义(p>0.05)。PPS 与FAS的统计结果一致。试验组和对照组屈光度95%置信区间均处于(-0.5D,0.5D),屈光度与预期屈光度差值均小于0.5D,申报产品与对照产品均能满足临床需要。
安全性评价本次临床试验未出现器械缺陷。SS中,试验组有57例(66.28%)受试者发生不良事件,与手术相关的不良事件有43例(50%),与验证产品植入的相关的不良事件有13例(15.12%),严重不良事件有7例(15.12%);对照组有52例(58.43%)受试者发生不良事件,与手术相关的不良事件有36例(40.45%),与验证产品植入的相关的不良事件有12 例(13.48%),严重不良事件有5例(5.62%)。将两组受试者的上述指标进行比较,其差异无统计学意义(P>0.05)。临床试验过程中发生的严重不良事件与试验器械无关。
根据申请人提供的申报资料, 经综合评价,在目前认知 水平上,认为该产品的上市为适用人群带来的受益大于风险。为保证用械安全, 基于对主要风险的规避,需在说明书中提示相关风险。
该产品属于同品种首个医疗器械。申请人的注册申报资料符合现行要求。依据《医疗器械监督管理条例》(国务院令第739 号)、《医疗器械注册与备案管理办法》(国家市场监督管理总局令第47 号)等相关医疗器械法规与配套规章,经系统评价注册申请资料后,在目前认知水平上, 该产品上市带来的受益大于风险, 符合现行的技术审评要求, 建议准予注册。
2023年8月21日
【临床试验软件管理系统:β-CTMS】
欢迎新老朋友体验、使用西格玛医学基于SaaS(Software-as-a-service,软件即服务)模式的β-临床试验管理系统,该系统面向企业(申办方)、医院(研究方)等行业组织,同时也面向PM、CRA、CRC等行业从业人员,做好大家临床试验的得力助手。

【医疗器械产品查询数据库】
欢迎新老朋友体验、使用西格玛医学开发的单维度、多维度、复合维度查询产品器械产品;全生命周期的产品信息展示/智能化同类产品比对/高水平的认领互动;全面的企业产品追踪/智能延续注册提醒,该系统面向企业(申办方)、医院(研究方)等行业组织,同时也面向PM、CRA、CRC等行业从业人员,做好大家临床试验的得力助手。

『精彩回顾』
【医疗器械学习篇】
14、医疗器械和体外诊断试剂(IVD)临床试验操作100个常见问题
【IVD学习篇】
【收藏篇】
1、医疗器械和IVD遗传办合规化申报的流程和探讨【2020年版】
【CRA必备】
3、临床试验100问
长按识别二维码 添加西格玛医学
获取更多器械资源

南京西格玛医学(证券代码:873450)是创新型医疗器械CRO,提供医疗器械临床研究、方案撰写、临床监查、数据管理、统计分析、器械SMO、受试者招募、第三方稽查等临床试验专项服务和器械产品注册体系的整体解决方案。


