▎药明康德内容团队编辑
益普生(Ipsen)和Day One Biopharmaceuticals今天宣布达成一项全球合作协议。根据协议条款,益普生将负责美国以外所有国家和地区的toverafenib的监管和商业化活动,包括toverafenib在未来所开发的新适应症。
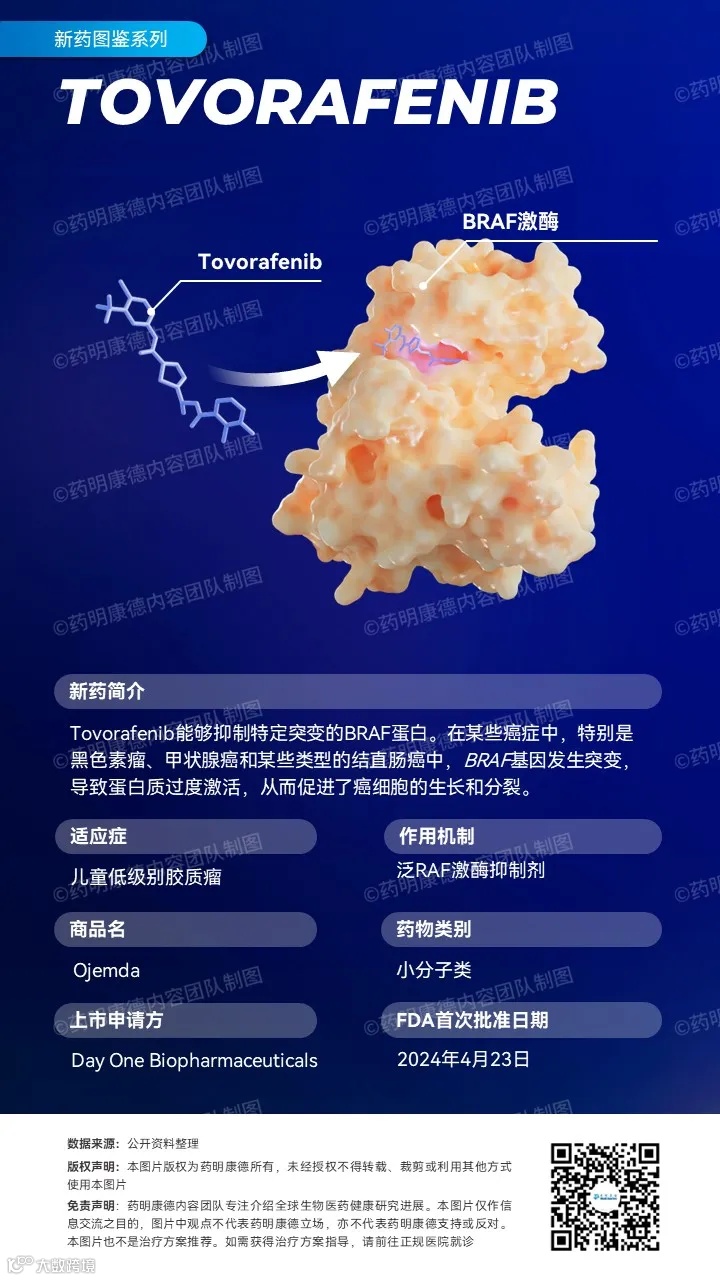
Toverafenib是一款具有大脑渗透性的RAF激酶抑制剂,在今年4月获得美国FDA加速批准(商品名为Ojemda),用于治疗6个月及以上的复发或难治性儿童低级别胶质瘤(pLGG)患者。这些患者携带BRAF融合或重排,或BRAF V600突变。根据美国FDA的新闻稿,这是FDA首次批准一种全身疗法,用于治疗携带BRAF重排(包括融合)变异的儿童低级别胶质瘤患者。Tovorafenib曾获得美国FDA授予的突破性疗法认定和罕见儿科疾病资格,用于治疗携带激活性RAF变异的pLGG。
儿科低级别胶质瘤是儿童中最常见的脑瘤,约占所有中枢神经系统肿瘤的30-50%。在pLGG患者中,BRAF基因融合是最常见的癌症驱动因素。此前获批的BRAF抑制剂只对携带BRAF V600突变的肿瘤有活性,而且在大脑中活性有限,并且不能用于携带BRAF融合的患者。
目前,tovorafenib正在3期临床试验FIREFLY-2中接受评估,作为一线单药疗法,治疗新确诊的儿童和青少年pLGG患者,他们携带RAF变异。
根据协议条款,Day One将获得约1.11亿美元的预付款,其中包括约7100万美元的前期付款以及4000万美元的股权投资,并有机会获得高达约3.5亿美元的额外产品上市和商业化里程碑款项。

▲欲了解更多前沿技术在生物医药产业中的应用,请长按扫描上方二维码,即可访问“药明直播间”,观看相关话题的直播讨论与精彩回放
[1] Ipsen and Day One enter into exclusive ex-U.S. licensing agreement to commercialize tovorafenib for the most common childhood brain tumor. Retrieved July 25, 2024, from https://www.ipsen.com/press-releases/ipsen-and-day-one-enter-into-exclusive-ex-u-s-licensing-agreement-to-commercialize-tovorafenib-for-the-most-common-childhood-brain-tumor-2918482/
免责声明:药明康德内容团队专注介绍全球生物医药健康研究进展。本文仅作信息交流之目的,文中观点不代表药明康德立场,亦不代表药明康德支持或反对文中观点。本文也不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
版权说明:本文来自药明康德内容团队,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转载至其他平台。转载授权请在「药明康德」微信公众号回复“转载”,获取转载须知。








