“ADV MATER∣微生物水凝胶装置,用于可持续的太阳能产氢”
文献信息:

Wang Hee Lee, Chang-Kyu Yoon, Hyunseo Park, Ga-Hee Park, Jae Hwan Jeong, Gi Doo Cha, Byoung-Hoon Lee, Juri Lee, Chan Woo Lee, Megalamane S. Bootharaju, Sung-Hyuk Sunwoo, Jaeyune Ryu, Changha Lee, Yong-Joon Cho, Tae-Wook Nam, Kyung Hyun Ahn, Taeghwan Hyeon, Yeong-Jae Seok, and Dae-Hyeong Kim.
https://doi.org/10.1002/adma.202306092
ADVANCED MATERIALS 影响因子:29.4
背景介绍
以微生物光合作用作为平台,进行燃料的生产在近期取得了阶段性进展,然而仍处于起步阶段。其中,气态反应物的供应、气态产物的平稳捕获和高效的太阳能传递,是微生物光合作用平台的难点。
在这里,受到睡莲叶子漂浮在水面上的启发,作者提出了在空气-水界面运行的微生物装置,用以解决上述问题。设计了可携带Rhodopseudomonas parapalustris的漂浮装置,且菌株在装置内保持有较高的固氮活性,氢气产率高达104 mmol·h-2·m-2,比放置在传统介质装置(2 cm深)中高出53倍。对装置进行放大(144 cm-2),产氢速率可达到1.52 L·h-2·m-2。高效的固氮和氢气生成、低成本制造和机械耐久性证实了这一漂浮微生物装置在实际和可持续太阳能转化中的潜力。
图文解读
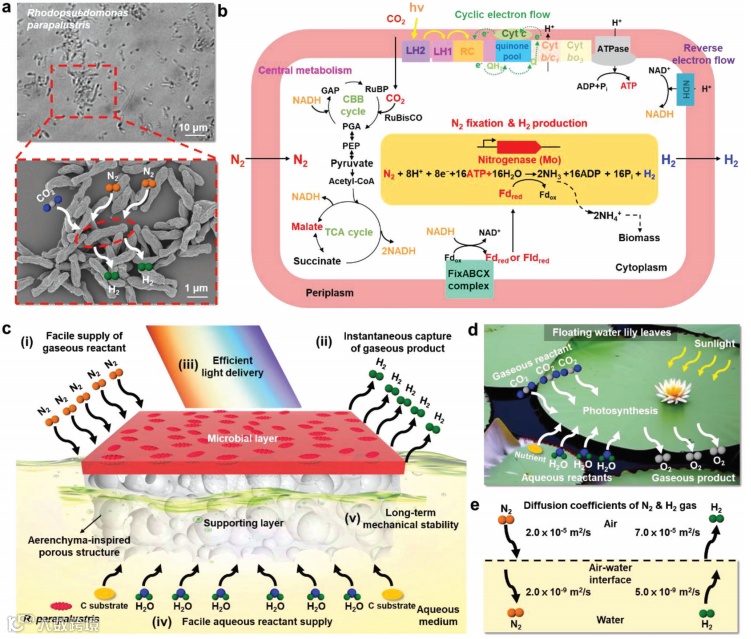
图1. 可漂浮微生物装置概述
a)R. parapalustris的光学图像(顶部)和扫描电子显微镜图像(底部),该菌可通过N2固定生成H2。
b)示意图显示了R. parapalustris的中心代谢途径、光合作用电子传递、逆向电子流以及固氮机制。NDH表示由nuo操纵子中的基因编码的NADH脱氢酶;Fd表示由fer1和ferN编码的过氧化亚铁蛋白;Fld表示由fldA编码的黄素蛋白。
c)可漂浮微生物装置的示意图和其在高效固氮和H2生成中的优势简要描述:
i)易于提供气态反应物,
ii)瞬时分离和捕获气态产物,
iii)有效的光传递,
iv)易于提供水相反应物,
v)长期机械稳定性。
d)睡莲叶在水面漂浮的示意图。漂浮性有助于通过便捷的气态反应物和水相反应物的传递以及光线的顺畅传递实现高效光合作用。
e)N2和H2在空气和水中的扩散系数。
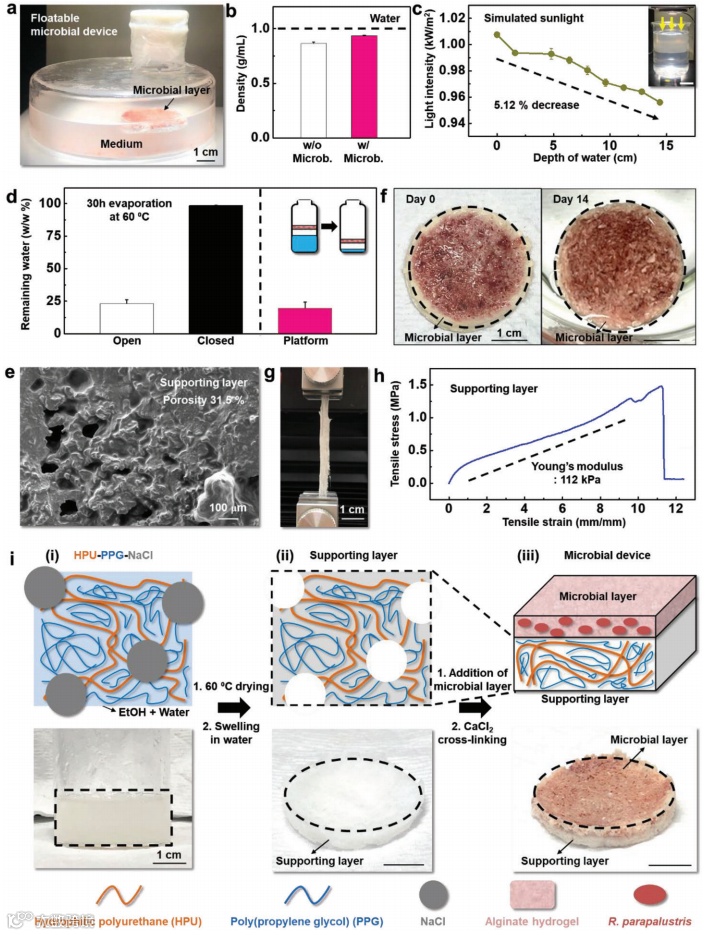
图2. 可漂浮微生物装置的特性和制备过程
a)装置浮在介质溶液中的光学图像。
b)不带微生物层(左)和带微生物层(右)的微生物装置密度。微生物层的添加导致密度略微增加,暗示浮力略微减小,但微生物装置仍在水中具有浮力。
c)光强度随深度变化的衰减。光强度在水中因散射和吸收而降低。插图显示了装满水(深度15厘米)的烧杯放置在光强度测量装置上的照片(比例尺:10厘米)。
d)经过30小时在60°C烘箱中蒸发后的水剩余百分比(右上角淡红色线)穿过装置的开放和封闭系统。对照组对应于没有装置的开放或封闭系统。
e)HPU-PPG弹性体-水凝胶混合物的SEM图像。
g)水凝胶拉伸后的光学图像。
h)HPU-PPG水凝胶的拉伸试验。
f)微生物装置在水中浸泡14天前(左)和后(右)的光学图像。
i)装置制备过程的示意图(顶部)和光学图像(底部)。
i)形成HPU-PPG-NaCl凝胶。
ii)通过干燥和膨胀形成支撑层。
iii)通过CaCl2交联在支撑层上嵌入
R. parapalustris的微生物层,促进海藻酸盐水凝胶生物复合材料的凝胶化。
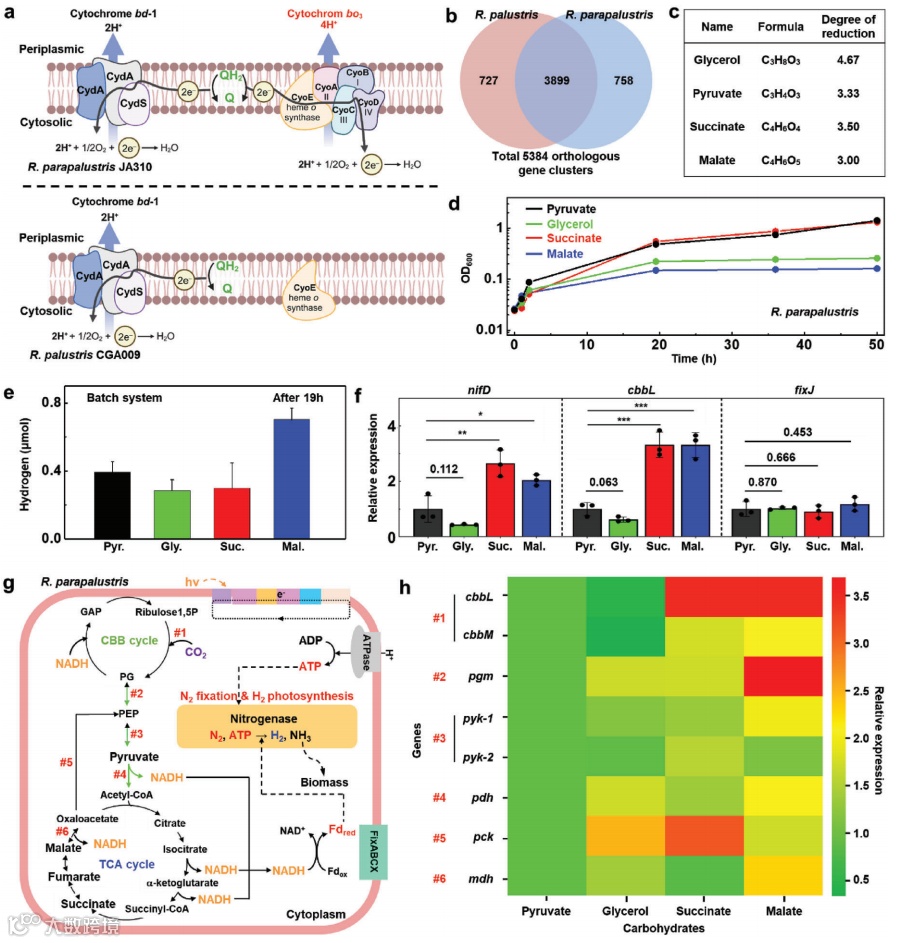
图3. 对R. parapalustris的表征
a)R. parapalustris JA310和R. palustris CGA009中的细胞色素bd-1和bo3组分的示意图。
b)Venn图表示R. palustris CGA009和
c)碳基底的正式还原程度。
d)R. parapalustris JA310菌株在添加了指示的碳基底的IFO802培养基中的生长比较。
e)R. parapalustris在指示的碳基底上生长产生的H2产量。
f)相对于参考基因rpoD,R. parapalustris在指定碳基底上生长时nifD、cbbL和fixJ的转录水平。fixJ的转录水平被用作阴性对照。转录水平以与参考基因rpoD的比率形式呈现(***p < 0.005,**p < 0.01,*p < 0.05)。
g)R. parapalustris菌株在光合生长期间的中心代谢通路的示意图。生产H2的代谢途径用红色数字标注。
h)在各种碳基底上生长的R. parapalustris中编码代谢反应酶的基因的差异表达分析(如f所示)。mRNA水平显示为与在丙酮酸上生长的细胞相对的比率。
e)和f)中的平均值和标准偏差来自三次独立测量。
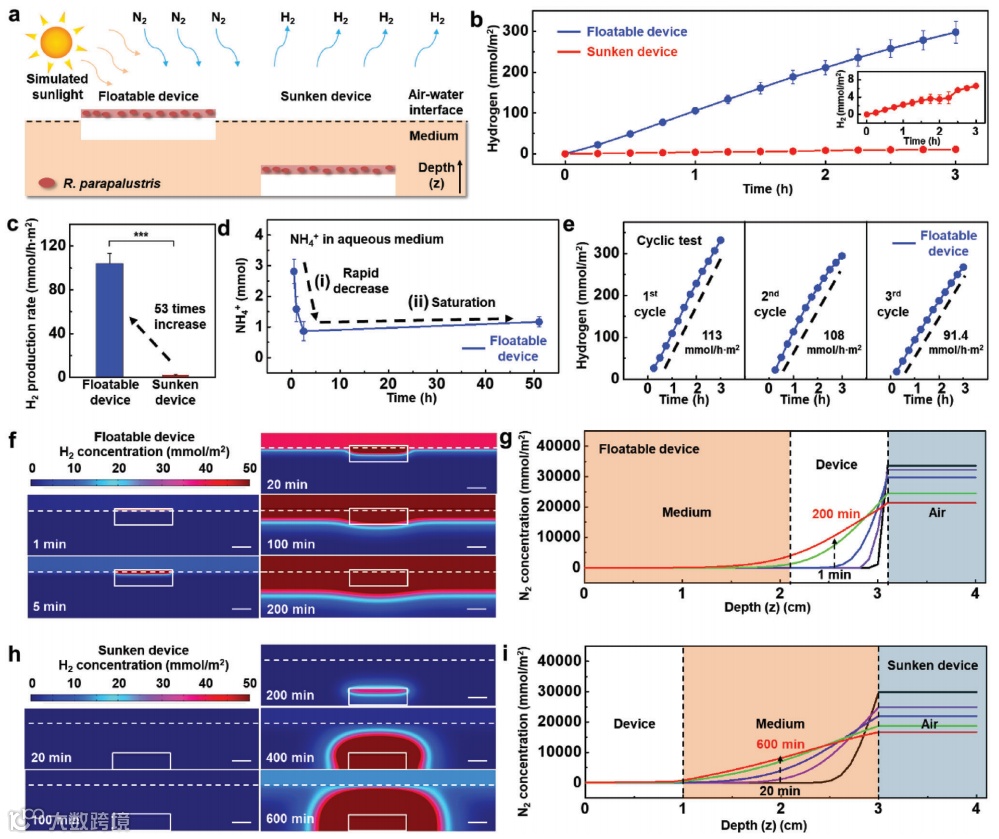
图4. 可漂浮微生物装置的太阳能H2产生
a)在微生物N2固定和H2产生期间,可漂浮和沉没装置的示意图。
b)在模拟阳光下,可漂浮(蓝色)和沉没(红色)装置产生H2的时间过程。插图显示了沉没装置产生的H2的放大视图。
c)可漂浮(蓝色,104 mmol h−1 m−2)和沉没(红色,1.96 mmol h−1 m−2)装置的H2产生速率(***p < 0.001,独立样本t检验)。
d)在模拟阳光照射可漂浮装置时,水介质中NH4+的时间过程,显示 i)迅速减少,然后 ii)饱和。
e)循环测试期间可漂浮装置产生的H2的时间过程。
f)H2浓度分布(比例尺:1厘米)和 g)随着水介质深度(z)的变化的N2浓度,针对不同时间点的可漂浮装置:1分钟(黑色),5分钟(紫色),20分钟(蓝色),100分钟(绿色)和200分钟(红色)。
h)H2浓度分布(比例尺:1厘米)和 i)随着水介质深度(z)的变化的N2浓度,针对不同时间点的沉没装置:20分钟(黑色),100分钟(紫色),200分钟(蓝色),400分钟(绿色)和600分钟(红色),由模拟估算。
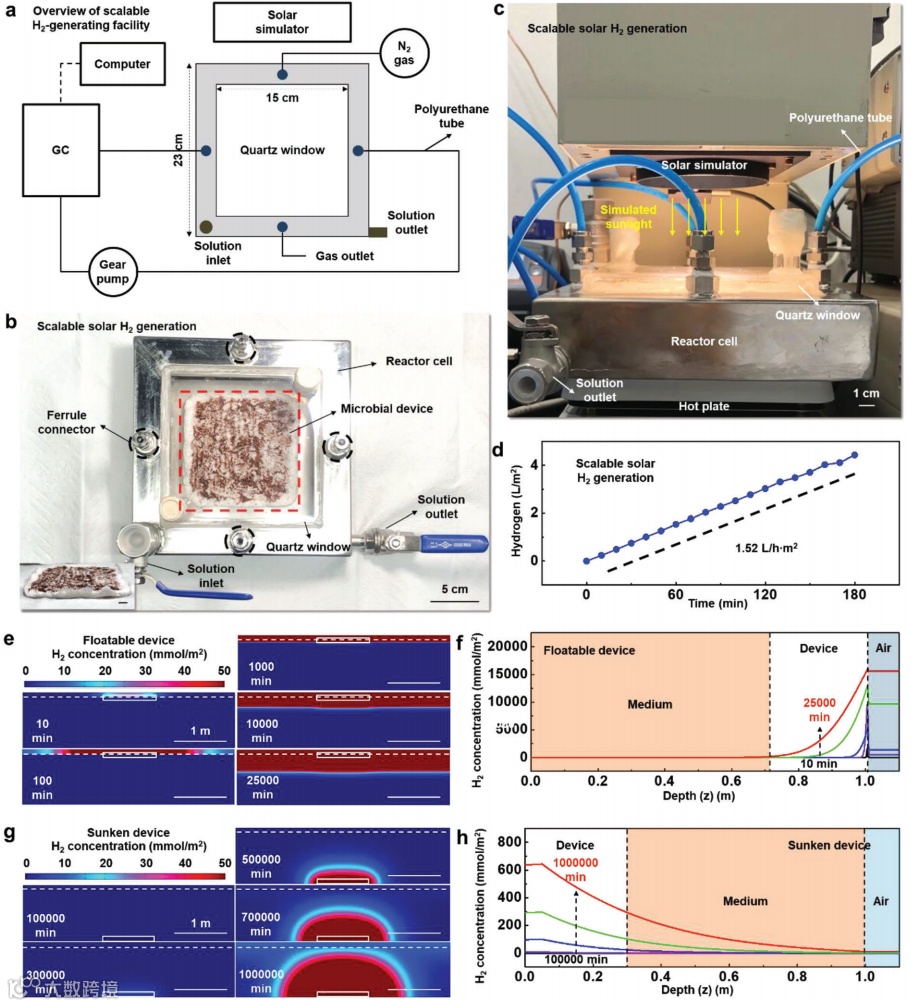
图5. 可漂浮微生物装置的扩展
a)可扩展H2产生装置设计的示意图。
b)装配在反应器单元中的放大微生物装置的光学图像。插图显示了一个长为12厘米,宽为12厘米的装置的侧视图。
c)用于太阳能H2生产规模化的反应器单元的光学图像(太阳模拟器下AM 1.5 G照明)。
d)放大的可漂浮装置产生H2的时间过程。
e)H2浓度分布和f)H2浓度作为水介质深度(z)的函数的浮漂装置以及g)H2浓度分布和h)H2浓度作为水介质深度(z)的函数的沉没装置在不同时间点(例如,10、100、1000、10000、25000、100000、300000、500000、700000和1000000分钟)上,通过 1 m2规模的模拟估算。
合成生物学相关内容讨论与合作,及文章投稿
欢迎联系我:shalafangjian
了解更多合成生物学内容,请关注 iSynFox 🦊:


