摘要
对于经皮微创局部消融术治疗肝脏内的恶性病灶,可采用电脑断层扫描(CT)荧光透视或超声(US)定位消融探头。然而肝1段和肝8段上部的病灶很难通过CT荧光透视和超声指导到达,即使对于经验丰富的介入医师,穿刺路径也甚为棘手,手术难度大。此外,肝门附近的血管时常有撕裂的风险。我们报告了一例乳腺癌肝转移瘤位于肝脏I段,常规CT或超声指导下难以到达,但我们通过CT下立体定向导航系统(Cascination AG,Bern,Switzerland)指导消融针精确穿刺,可进行有效的微波消融。根据规划扫描和影像至患者的配准,消融针可进行精确定位及放置,这样有利于重要组织结构的保留,同时可避免伤及相邻的脆弱血管。该消融治疗无并发症,转移病灶完全消融。从介入治疗至今的18个月,也没有出现肿瘤复发的情况。
关键词:
微波消融;CT下导航;肝脏;微创治疗
介绍
肝脏是转移性疾病的常见部位,尤其是结直肠癌[1]。当今外科手术如:外科切除术或肝移植,只适用于少数符合条件的人群[2]。因此,还可以选择其他各种介入治疗方案。对于局部热消融,射频消融(RFA)和微波消融(MWA)已经发展起来。其他局部治疗方法有激光诱导间质热疗、冷冻疗法、CT引导的间质高剂量率近距离放射疗法或不可逆电穿孔等[3]。在我们的研究中,微波消融是最常用的治疗方法,我们报告的病灶处于肝I段非常不利的位置,采用CT下立体定向导航微波消融术(SIMWA)成功治疗了乳腺癌肝转移。
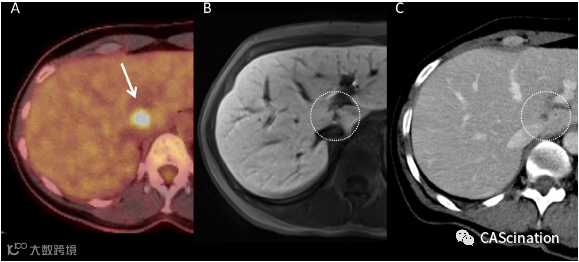
 图 1 – FDG PET-CT(A,箭头),肝胆相中的MRI(用Gadoxetate (Primovist);B,点形圆)和静脉相中的对比增强CT(C,点形圆)显示尾状叶转移,直接附于左门静脉和下腔静脉。
图 1 – FDG PET-CT(A,箭头),肝胆相中的MRI(用Gadoxetate (Primovist);B,点形圆)和静脉相中的对比增强CT(C,点形圆)显示尾状叶转移,直接附于左门静脉和下腔静脉。
病例报告
本报告中患者是前瞻性临床研究的一部分,旨在评估接受经皮SIMWA治疗肝转移(非结直肠癌转移)的短期临床结果。这项研究得到了当地伦理委员会的批准。2016年5月,我院提供一位52岁女性患者,在筛查乳房X光片上发现右乳房异常。活检显示有浸润性导管癌(雌激素受体60%,孕酮受体5%-20%,Ki67 25%,阳性)。随后的FDG PET-CT显示肝脏尾状叶有活动性损伤。最后的肿瘤阶段是 T2, N0, M1。接受曲妥珠单抗(赫赛汀)、珀特珠单抗(perjeta)和多西他赛(taxotere)共5个周期(主要副作用导致多西他赛剂量减少)的化疗,随后接受曲妥珠单抗和珀特珠单抗的系统治疗。接受曲妥珠单抗(赫赛汀)、珀特珠单抗(perjeta)和多西他赛(taxotere)共5个周期(主要副作用导致多西他赛剂量减少)的化疗,随后接受曲妥珠单抗和珀特珠单抗的系统治疗。化疗开始后4个月,FDG-PET-CT显示肝转移活性降低(图1a)。右乳房手术(节段切除,肿瘤边缘阴性)1个月后辅以高剂量近距离放射治疗(累积剂量32(Gy))。
由于尾叶位置不利(图1),距下腔静脉仅4 mm,距左门静脉3 mm。因此,考虑到患者的肿瘤情况,跨学科肿瘤委员会推荐CT下SIMWA治疗。
由于病灶位于左门静脉和下腔静脉之间,即使是有经验的介入医师,也很难将消融探针精确地定位和穿刺,同时不对血管造成损伤更是困难。因此,使用CAS- One导航系统进行该手术。扫描之前,在患者体表贴上六个球形标记,可支持图像至患者的实时配准。患者在全麻状态下使用高频喷射呼吸机,当呼吸平稳时获得初始CT扫描[4]。基于CT扫描数据,对穿刺路径进行三维规划。通过实时跟踪患者的位置和穿刺定位器,介入医师能够以正确的角度和准确的规划深度插入消融针,以到达计划消融区的中心。
规划阶段的初始CT扫描显示肝I段有直径为8 mm的已知转移(图2A)。消融探针(Accu2ioTMA, Angio-dynamics, NY)经皮穿刺肝组织11 cm。进行第二次扫描,可查看消融针的位置是否精确。导航装置内的规划软件可确定具有足够安全边界的消融区域,同时可避免伤害到重要的血管结构(图2A)。
软件计算出所需能量的强度和持续时间,按计划进行微波消融,功率100W,持续2分钟。术后再进行一次CT扫描,通过术前术后的CT扫描对比,(图2B)显示消融面积为30×16 mm,完全符合计划且覆盖初始病灶,也提供了足够的安全边界。下腔静脉和左门静脉未受影响。
3个月和6个月随访期的钆酸盐增强MRI显示介入治疗后的变化,同时考虑到对比剂动态和扩散加权成像的磁共振序列,没有任何残留肿瘤痕迹,对比剂细胞内摄取减少(图3B)。
用曲妥珠单抗和帕图珠单抗进行的全身化疗于2017年4月结束。直到今天,患者仍接受曲妥珠单抗的单一治疗。

图2-之前的mwa三维消融区域规划(a)支持在避开敏感血管结构的同时精确定义安全边界。
介入治疗后对照(B)显示计划组织和治疗组织之间几乎完全匹配。
讨论
局部消融手术的有效性取决于所应用技术的物理特性和探针在病灶内的精确定位。目标组织的温度是至关重要的,它受组织密度、热导率和组织灌注导致的温度损失等影响。热量通过探头传递,探头可以通过经皮或腹腔镜进行穿刺。为了成功消融,应均匀地将温度升高至50°C-60°C[5]。在射频消融中,热量是由200兆赫-3千兆赫射频范围内的交流电产生的。肿瘤周围只有几毫米的组织接受主动加热,大部分组织通过传导进行加热[6]。

图3–在消融后的CT对照扫描中,病灶完全覆盖,左门静脉分支和主肝静脉未受损(A,*号)。经肝穿刺路在针收缩过程中通常采用小能量治疗,以防止肿瘤细胞扩散。在消融后的对照扫描中可以很清楚地看到凝血通路(A,虚线箭头)。6个月的肝胆相中使用钆酸盐的MRA随访显示尾状叶有轻微的收缩疤痕。
在病例中,由于其优越的物理性能,MWA治疗是有利的。MWA产生900兆赫至2.4兆赫的辐射[7],与RFA相比,不易受到烧蚀组织的阻抗,也不完全依赖于水合组织[6]。在MWA治疗中,能量沉积更多,可能导致更均匀的加热[8]。此外,由于靠近血管(门静脉和肝静脉),预计会产生显著的散热效果,但在MWA中,这种影响不太明显,而对于大的血管动脉,RFA是不可行的。 因此MWA在预防复发和局部复发方面似乎更有效[10]。
导航系统支持通过定义一个安全的穿刺口和穿刺针尖端进行精确的路径规划,设置消融能量和消融时间来预先规划预期消融区域。消融后通过术前术后影像融合对比,检查消融的结果和成效。可以避免大手术,治疗后并发症发生率较低[11]。
经皮介入消融术是治疗肝肿瘤的一项重要进展,对于因合并症或潜在肝病而不适合手术的患者来说,经皮消融术是一种很好的替代治疗策略。使用基于CT的立体定向导航系统在技术上是可行和安全的,对于邻近敏感组织、不利位置的肿瘤病灶来说,微创介入治疗是更好的选择。
声明
所有作者都声明他们没有利益冲突。
补充材料
与本文相关的补充材料可以在doi的在线版本中找到:10.1016/j.radcr.2018.10.010.
参考文献
[1] Poston GJ, Tait D, O’Connell S, Bennett A, Berendse S.
Diagnosis and management of colorectal cancer: summary
of NICE guidance. BMJ 2011;343:d6751.
[2] Van Cutsem E, Cervantes A, Adam R, Sobrero A, Van
Krieken JH, Aderka D, et al. ESMO consensus guidelines for
the management of patients with metastatic colorectal
cancer. Ann Oncol 2016;27(8):1386–422.
[3] Schnapauff D, Denecke T, Grieser C, Collettini F, Seehofer D,
Sinn M, et al. Computed tomography-guided interstitial HDR
brachytherapy (CT-HDRBT) of the liver in patients with
irresectable intrahepatic cholangiocarcinoma. Cardiovasc
Intervent Radiol 2012;35(3):581–7.
[4] Engstrand J, Toporek G, Harbut P, Jonas E, Nilsson H,
Freedman J. Stereotactic CT-guided percutaneous microwave
ablation of liver tumors with the use of high-frequency jet
ventilation: an accuracy and procedural safety study. AJR Am
J Roentgenol 2017;208:193–200.
[5] Vogl TJ, Nour-Eldin NA, Hammerstingl RM, Panahi B,
Naguib NNN. Microwave ablation (MWA): basics, technique
and results in primary and metastatic liver
neoplasms—review article. RoFo 2017;189:1055–66.
[6] Salati U, Barry A, Chou FY, Ma R, Liu DM. State of the ablation
nation: a review of ablative therapies for cure in the
treatment of hepatocellular carcinoma. Future Oncol
2017;13:1437–48.
[7] Hoffmann R, Rempp H, Clasen S. Microwave tumor ablation.
New devices, new applications? Der Radiologe 2012;52:22–8.
[8] Yang D, Converse MC, Mahvi DM, Webster JG. Measurement
and analysis of tissue temperature during microwave liver
ablation. IEEE Trans Bio-Med Eng 2007;54:150–5.
[9] Liang P, Wang Y, Yu X, Dong B. Malignant liver tumors:
treatment with percutaneous microwave
ablation–complications among cohort of 1136 patients.
Radiology 2009;251:933–40.
[10] Correa-Gallego C, Fong Y, Gonen M, D’Angelica MI, Allen PJ,
DeMatteo RP, et al. A retrospective comparison of microwave
ablation vs. radiofrequency ablation for colorectal cancer
hepatic metastases. Ann Surg Oncol 2014;21(13):4278–83.
[11] Song P, Sheng L, Sun Y, An Y, Guo Y, Zhang Y. The clinical
utility and outcomes of microwave ablation for colorectal
cancer liver metastases. Oncotarget 2017;8:51792–9.


![[文献资料]CT引导下导航微波消融术治疗肝I段乳腺癌转移灶](https://cdn.10100.com/user/22a2d202eec02314494fb7b3958fa84f.png?x-oss-process=style/180x)