距2018年底,仿制药质量和疗效一致性评价的“时限”越来越近,国家食药监管总局不断“放大招”,确保按时按量完成历史性任务。
昨日,国家食药监管总局“一把手”毕井泉在紫光阁微平台撰文,并透露:2018年底前必须完成“一致性评价”的289种已上市仿制药中,94.8%的品种,开展了评价工作。

(来源:紫光阁微平台)
也就是说,根据国家食药监总局的最新统计,至少已有273个仿制药品种,有一个以上的生产企业,选择通过“一致性评价”,拓展市场份额。
8月21日,总局通过调研,公布企业开展289目录内仿制药质量和疗效一致性评价的基本情况,健识局也有做详细报道《一致性评价清单:3品种被抛弃,23个成“独家”!》。
毕井泉这样解读“一致性评价”的目标:逐步淘汰与原研药疗效不一的药品,最终实现仿制药在临床使用上,可与原研药相互替代,提高我国制药工业发展质量和国际竞争力。
针对8月《关于仿制药质量和疗效一致性评价工作有关事项的公告》(以下简称公告,健识君注)未明确之处,上周,国家食药监总局再发18条问答,补充阐明“2018年底,289种药品完成一致性评价”的态度和实现路径。
健识君从18条问答中,梳理出企业实操过程中,普遍关心的六问六答,以飨读者


2018年底必须完成质量和疗效一致性评价的289个仿制药品种,参比制剂都找全并明确了吗?
为了便于企业开展研究工作,总局目前已发布8批610个品种规格的参比制剂,包括《2018年底前须完成仿制药一致性评价品种目录》(以下简称《289品种目录》)中的163个品种(219个品规)。
该目录中,另约有90个改规格、改剂型、改盐基的品种,已按照此前发布的《仿制药质量与疗效一致性评价工作中改规格/改规格/改盐基药品(口服固体制剂)评价一般考虑》三份技术指南,明确其参比制剂的选择依据(顺序)。
至此,我局已给出《289品种目录》中大多数品种(约253种)的参比制剂选择指导。
接下来,我局将继续对企业备案的参比制剂进行遴选和确认和发布。





去哪里购买参比制剂?买到假冒伪劣的参比制剂怎么办?
关于参比制剂获得事宜,企业可以通过申报一次性进口申请及进口备案、通关等程序来获得参比制剂;除此之外,《公告》明确企业可以通过其他方式获得参比制剂,在提交一致性评价资料时,仅需在资料中提供购买凭证、产品包装及说明书等材料,或以其他适当方法证明参比制剂真实性即可。

需要强调的是,参与一致性评价的企业,是参比制剂的选择、购买及使用的责任主体,要对评级全过程负责。企业自行从境外采购的参比制剂,在评价过程中,被发现为假冒产品,应及时终止相关工作;总局将依法进行调查,如有证据证明企业非主观因素选择假冒产品,可免责。





参比制剂有了,但能够开展生物等效性试验的临床机构太少,政府有什么解决办法?
针对生物等效性试验机构“不足”问题,前期,我局已会同国家卫生计生委确定619家临床试验机构。《大扩容,149家医院获临床试验资质》
同时,我局已决定对生物等效性试验机构实行备案制管理,正在研究制定相关配套规定。今后,一致性评价中的生物等效性试验可以在现有经认定的临床试验机构进行,也可以在其他具备条件的机构进行。
另外,根据科学判定,药审中心会有些不必要的生物等效性试验进行豁免。





对通过一致性评价的品种,到底有哪些奖励政策和利好消息?
《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》(国办发〔2016〕8号)《国务院办公厅关于进一步改革完善药品生产流通使用政策的若干意见》(国办发〔2017〕13号)已先后给出比较具体的奖励政策,统合如下:
1、 优先采购。同品种药品通过一致性评价的生产企业达到3家或以上,各地药品集中采购时,未通过一致性评价的产品,排除在选购目录外。
2、 医保支持。有关部门正在加快按通用名制订医保药品支付标准,对通过一致性评价的药品品种,在医保支付方面予以适当支持,鼓励临床优先使用。
3、 生产扶持。药品生产企业如对通过一致性评价的药品生产线进行技术改造,有望申请到中央基建投资、产业基金等资金支持。
4、 广泛宣传。对通过一致性评价的药品,我局拟专门发布一类公告,及时向社会各界传递相关信息;将其纳入与原研药可相互替代药品目录,并以此为基础不断完善和发展,形成中国的“橙皮书”。
后期,我局将协同有关部门做好上述政策的细化落实,营造扶优汰劣的药品市场环境,提高医药产业集中度,引导优势企业形成规模化、专业化的药品生产格局,降低成本,保障市场供应。





通过一致性评价后,企业可否自行宣传,扩大“良心药”的知名度?
通过一致性评价的品种,国产药品报省级食品药品监管部门备案,进口药品报国家食品药品监督管理总局备案后可在说明书、标签中使用“通过一致性评价”标识。





有些临床必须的药品,可能因为生产成本、采购价格不成正比等原因,被生产企业普遍放弃一致性评价,可能由此造成新的药物短缺、患者用药断档等问题,总局是否有所考虑?
对影响市场供应、目前无替代的品种,由我局会同相关部委及时发布清单,鼓励企业研发申报仿制药,并加快审评审批,以保障市场供应。


全部选择放弃/暂时选择不放弃但未开展一致性评价的品种一览
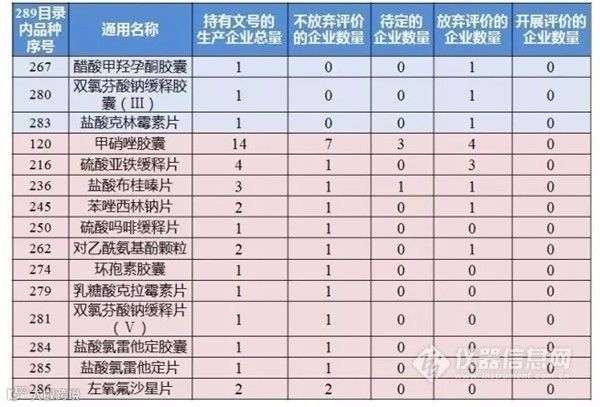
来源:国家食药监总局8月21日发布的企业开展289目录内仿制药质量和疗效一致性评价基本情况



企业在开展一致性工作遇到问题时,是否有反馈的渠道?
一致性评价审评的主体部门已调整至药审中心。企业在研究中遇到的具体问题,可以向药审心提出咨询,药审中心将对企业提出的问题进行研究。

内容来源:健识局
声明:该文章系转载,登载该文章目的为更广泛地传递医药市场信息,不代表四川汇宇制药赞同其观点。文章内容仅供参考。
四川汇宇制药有限公司www.huiyupharma.com国内唯一一家获得英国GMP认证的抗肿瘤注射剂生产企业和唯一一家获得欧盟地区药品放行资质的一家国家级高新技术企业,提供专业化研发咨询、合作开发、委托生产、产品注册、市场销售、药物警戒、欧盟地区药品放行等全方位的国际化定制服务。
联系方式:
0832-8808007 15583235168何经理
0832-8808016 13408335042龙经理

手指长按二维码,识别关注我们


