
爱思益普生物化学部(ICE Biochemistry, IBC)成立于2019年2月18日, 经过近五年的发展,已经成长为涵盖蛋白定制与产品,生物物理分析,酶学体系构建与筛选,生化机制研究,质谱分析,高通量与谱学筛选的六位一体的生物化学平台;团队经验丰富,leader 团队超过25人,平均行业从业经验超过6年,拥有1100+的ready to use的酶学靶点平台,300+的靶标蛋白产品,以及50+经SPR 验证的靶标平台等,助力国内外合作伙伴的新药研发。


蛋白酶,也被称为蛋白水解酶,是一类催化蛋白质内肽键水解的酶。它们负责将蛋白质分解成更小的片段,最终导致单个氨基酸的释放。这个过程被称为蛋白质水解。
蛋白酶具有显著的底物特异性,这意味着它们可以选择性地靶向和切割蛋白质分子内的特定肽键。这种特异性是由每个蛋白酶活性位点的独特结构决定的,这使得它能够识别和结合特定的氨基酸序列。
有几种类型的蛋白酶,包括丝氨酸蛋白酶、半胱氨酸蛋白酶、天冬氨酸蛋白酶和金属蛋白酶。每种类型的蛋白酶利用不同的机制和催化残基进行蛋白质水解。
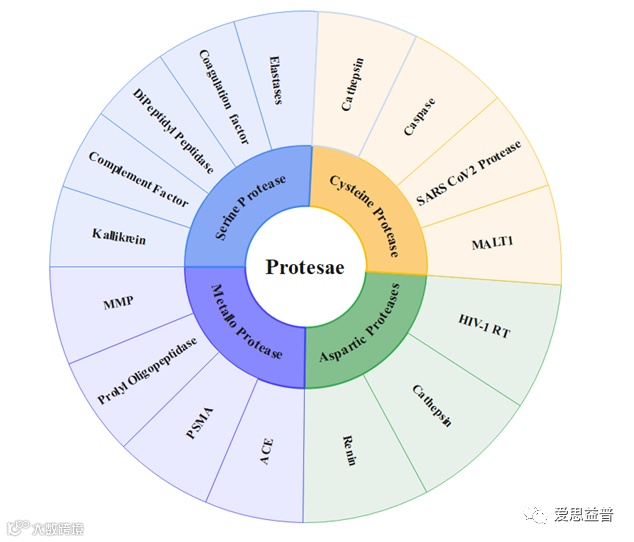
图1:蛋白酶分类

图2:丝氨酸蛋白酶家族数据展示
2. 半胱氨酸蛋白酶
半胱氨酸蛋白酶的活性部位含有Cys-His-ASN三联体。存在于活性中心的组氨酸残基充当质子供体,增强半胱氨酸残基的亲核性。为了防止不需要的蛋白质降解,像其他蛋白水解酶(丝氨酸、天冬氨酸和金属蛋白酶)一样,半胱氨酸蛋白酶也被合成为无活性前体(或酶原)。半胱氨酸蛋白酶酶原含有一种原结构域,可以阻止底物进入活性位点。除了作为内源性抑制剂外,原结构域可能在蛋白质折叠和/或细胞内分选中具有其他作用。酶的酶原激活通常发生在亚细胞腔室或细胞外环境中,在这种环境中,特定的酶发挥其生物功能。酶原转化可以通过辅助分子完成(例如,胰蛋白酶原在Ca2+存在下转化为胰蛋白酶),通过需要显著降低pH值的自催化过程,以及通过反式活化等其他酶来完成。

图3:半胱氨酸蛋白酶自激活模型
2.1 组织蛋白酶家族(Cathepsins)
根据蛋白水解机制,组织蛋白酶主要包括半胱氨酸组织蛋白酶、丝氨酸组织蛋白酶(Cathepsin A和Cathepsin G)和天冬氨酸氨酸组织蛋白酶(Cathepsin D和Cathepsin E)。其中半胱氨酸组织蛋白酶是其中最重要的一类,它由11个成员组成(Cathepsin B、C、F、H、K、L、O、S、V、W和X),其中以Cathepsin B研究最多,它们都拥有由半胱氨酸、组氨酸和天冬酰胺组成的保守活性位点。
组织蛋白酶是由无活性的前体酶原(preprocathepsin)水解而成,其在体内的合成途径为:首先在核糖体结合膜上以前体酶原的形式合成,经转铁蛋白先进入内质网,然后进入高尔基体,同时通过糖基化及磷酸化作用形成甘露糖-6-磷酸蛋白,最后通过溶酶体上甘露糖-6 -磷酸特异性受体的识别作用,间接转运到溶酶体中。
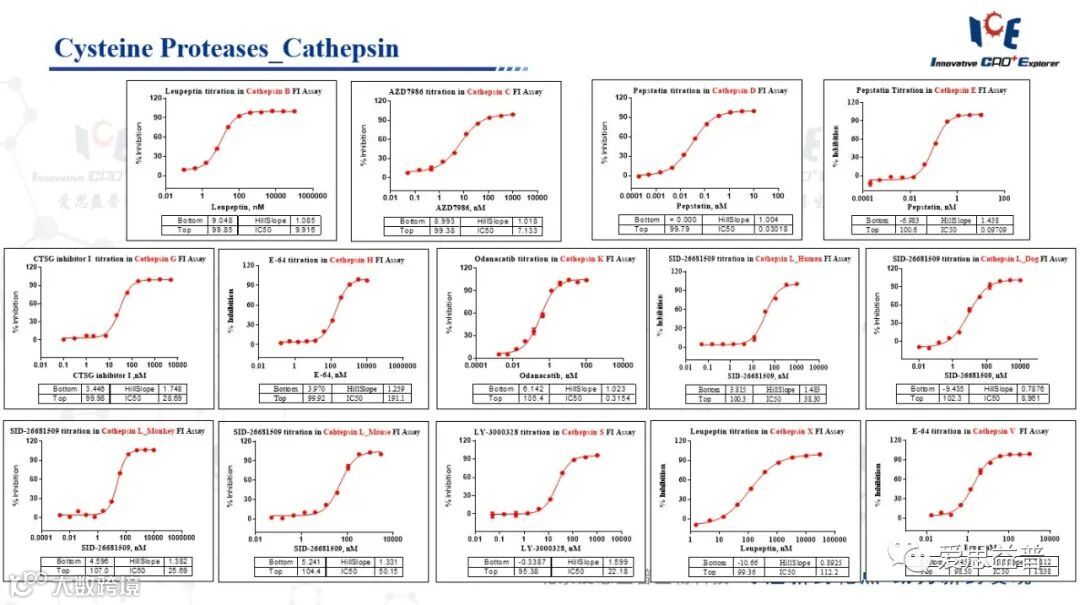
图4:组织蛋白酶家族数据展示
2.2 Caspase家族
Caspase是一个半胱氨酸蛋白酶家族,与秀丽隐杆线虫程序性细胞死亡蛋白CED-3同源。半胱天冬氨酸酶及其远亲的半胱天冬氨酸酶和副半胱天冬氨酸酶已在系统发育上较远的非后生动物类群中发现,包括植物、真菌和原核生物。Caspase是一类含半胱氨酸的天冬氨酸蛋白水解酶,存在于细胞质中。它们在进化上是保守的,参与真核细胞的生长、分化和凋亡死亡。目前已知有18种与哺乳动物相关的caspase,其中14种与胎盘哺乳动物相关(图1)。除了caspase-11和-13与人类caspase-4同源,在小鼠和牛中特异性表达外,其余均在人类中表达。
细胞中合成的Caspases以无活性的酶原状态存在,经过活化后方能执行剪切功能。Caspase的活化是有顺序的多步水解的过程,Caspase分子各异,但是它们活化的过程相似。需在两个亚基的连接区的天冬氨酸位点进行切割,结果产生了由两个亚基组成的异二聚体,再由两个二聚体形成有活性的四聚体。通常N-末端的肽在活化时也被除去,但对于Caspase-9是否去除N-末端肽对活性无影响。

图5:Caspase家族分类及数据展示
3. 天冬氨酸蛋白酶
天冬氨酸蛋白酶(Aspartic Proteases)是一类携带磷酰胆碱成分的蛋白酶分子,广泛分布于多种生物中,包括病毒、真菌、寄生虫、哺乳动物及植物等,该类蛋白酶以单链的酶原形式合成,经过加工形成具有催化活性的蛋白酶单体或异源二聚体,参与机体的新陈代谢及生物调控作用。
天冬氨酸蛋白酶基因在不同种属之间具有高度保守性和相似性,具有以C2为对称轴的两个双叶型三级结构;典型的天冬氨酸肽链内切酶在其活性中心包含两个天冬氨酸残基,该催化残基位于保守区Asp-Thr/Ser-Gly (DT/SG)基序内并形成酶活性位点。到目前为止,已有 70 多种真核生物的天冬氨酸蛋白酶得到证实,主要包括胃蛋白酶(Pepsin)、肾素(Renin)、组织蛋白酶 D (Cathepsin D)、逆转录病毒蛋白酶(HIV-1 proteinase)等,其主要分布于哺乳动物的胃(如:胃蛋白酶 pepsin 和凝乳酶 chymosin)、肾(如:肾素,renin)以及溶酶体(如:组织蛋白酶D和E)中;在植物体内,天冬氨酸蛋白酶广泛分布于植物的种子、叶片、茎、花等组织中,主要参与前体蛋白加工、蛋白质降解、细胞程序性死亡等过程,同时也参与植物抗病、抗逆、叶片衰老等;另外,在其他生物如酵母、真菌、寄生虫和逆转录病毒等也发现了天冬氨酸蛋白酶的存在。如在恶性疟原虫中发现的半胱氨酸蛋白酶(plasmepsin),能够在受染红细胞的纳虫空泡内对血红蛋白进行初步裂解,导致红细胞的破坏。
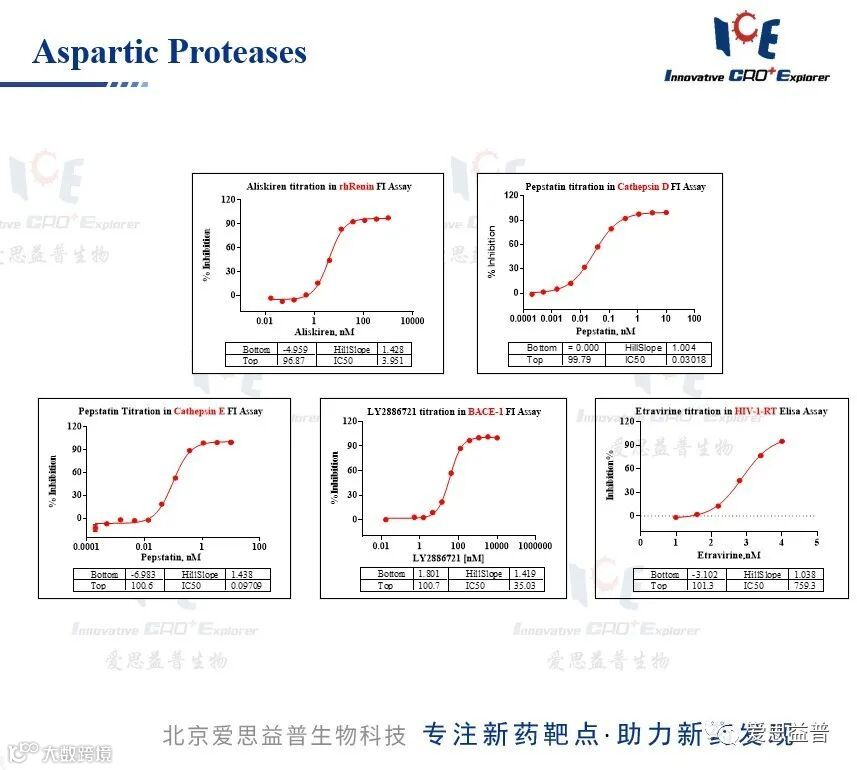
图6:天冬氨酸蛋白酶数据展示
4. 金属蛋白酶
金属蛋白酶是四种主要蛋白酶类型中最多样化的,迄今已分类为50多个家族。大多数金属蛋白酶需要锌,但也有一些需要激活水分子的钴。金属离子通过氨基酸配体与蛋白质配位。已知的金属配体有His、Glu、Asp或Lys。与氨基肽酶相比,这些蛋白酶大多数是内肽酶。MMPs、ADAMs和ADAMTSs受TIMPs调控,对这些家族的不同成员具有不同的特异性。
金属蛋白酶在生物学的许多方面都很重要,从细胞增殖、分化和细胞外基质(ECM)的重塑到血管形成和细胞迁移。这些事件在正常发育和肿瘤进展的器官发生过程中发生多次。这些事件背后的金属蛋白酶作用机制包括:生长因子的蛋白水解裂解,使它们可以在没有直接物理接触的细胞中使用;ECM的降解,使初始细胞可以跨组织移动到附近的基质中;调节受体裂解以终止迁移信号。这些过程大多需要基质金属蛋白酶(MMPs)或金属蛋白酶分解素(ADAMs)与金属蛋白酶的天然组织抑制剂(TIMPs)之间的功能保持微妙的平衡。
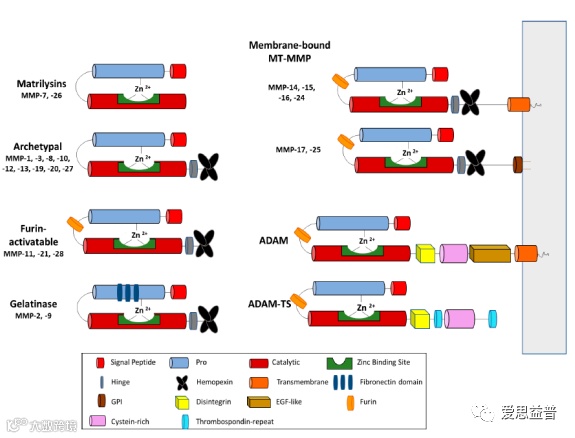
图7:金属蛋白酶分类
4.1基质金属蛋白酶家族(MMPs)
基质金属蛋白酶(MMPs),也称为基质蛋白,是参与ECM降解的锌依赖性内肽酶。在正常生理条件下,MMPs的活性在转录水平、前体酶原的激活水平、与特定ECM成分的相互作用水平以及内源性抑制剂的抑制水平上受到精确调节。TIMPs是基质金属蛋白酶的特异性抑制剂,参与控制组织中MMPs的局部活性。MMPs由多种结缔组织和促炎细胞分泌。在正常生理条件下,MMPs的表达通常很少,因此可以维持体内平衡。然而,MMPs受激素、生长因子和细胞因子的调节,并参与卵巢功能。
MMPs包含一个高度多样化的酶家族,它们具有几个共同的特性和结构域结构。根据它们的结构域结构和底物偏好,传统上将它们分为:胶原酶、基质溶酶、明胶酶、基质溶酶、膜型MMPs (MT-MMPs)等。
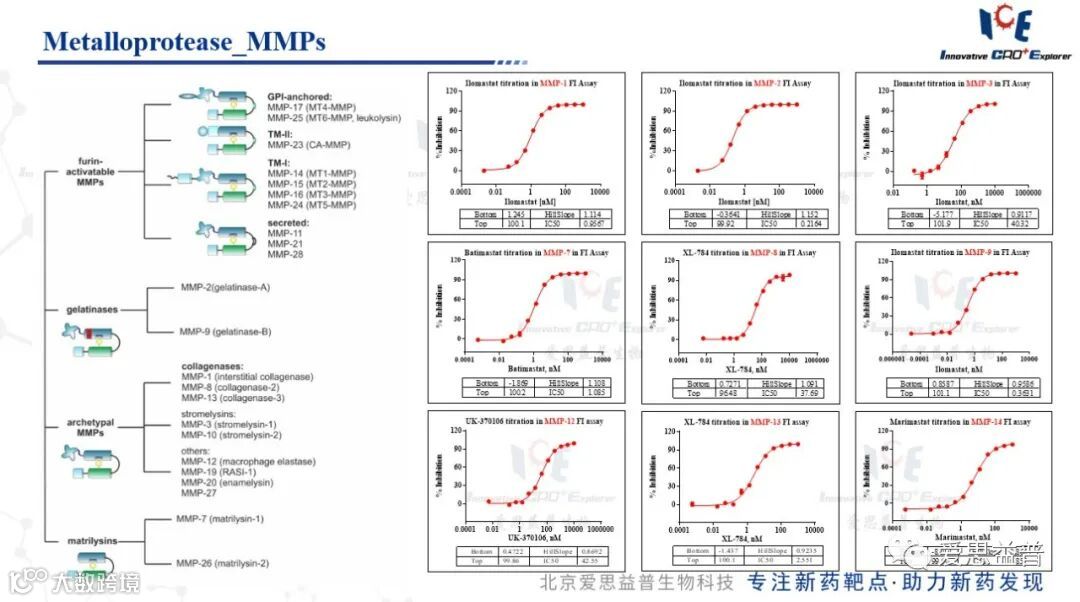
图8:基质金属蛋白酶数据展示
4.2 氨基肽酶家族
氨基肽酶(AP)是一种金属酶,通过切断N端氨基酸水解肽和多肽,并参与细胞内蛋白质的最终消化。APs在蛋白质成熟、信号转导和细胞周期控制等过程中发挥重要作用。这些酶在心血管和肾脏功能的控制中尤为重要。APs参与全身和局部肾素-血管紧张素系统的调节,也调节神经肽、激肽、免疫调节肽和细胞因子的活性,甚至有助于胆固醇摄取和血管生成。
4.3 二肽基肽酶家族
二肽基肽酶是广泛分布的外肽酶,在蛋白质水解中起着核心作用。二肽基肽酶家族,包括DPP4、DPP7、DPP8、DPP9、成纤维细胞活化蛋白等,可切割倒数第二个脯氨酸残基后的肽键,具有丰富的药物靶点。DPP4或CD26是一种丝氨酸蛋白酶,可在多种免疫细胞和各种器官的上皮细胞上检测到。除了膜结合酶外,在几种体液中还检测到具有催化活性的可溶性形式。这两种变异都从各种趋化因子、神经肽和激素的N端切割二肽。DPP4通过靶向不同的底物,在免疫调节、炎症、氧化应激、细胞粘附和细胞凋亡中发挥关键作用。DPP4抑制剂通常用作降糖药。DPP8和DPP9表现出类似DPP4的活性,并且彼此具有非常高的序列相似性。DPP8和DPP9是细胞内n端二肽基肽酶(优先为脯氨酸后酶),在免疫反应和癌症生物学中起病理生理作用。
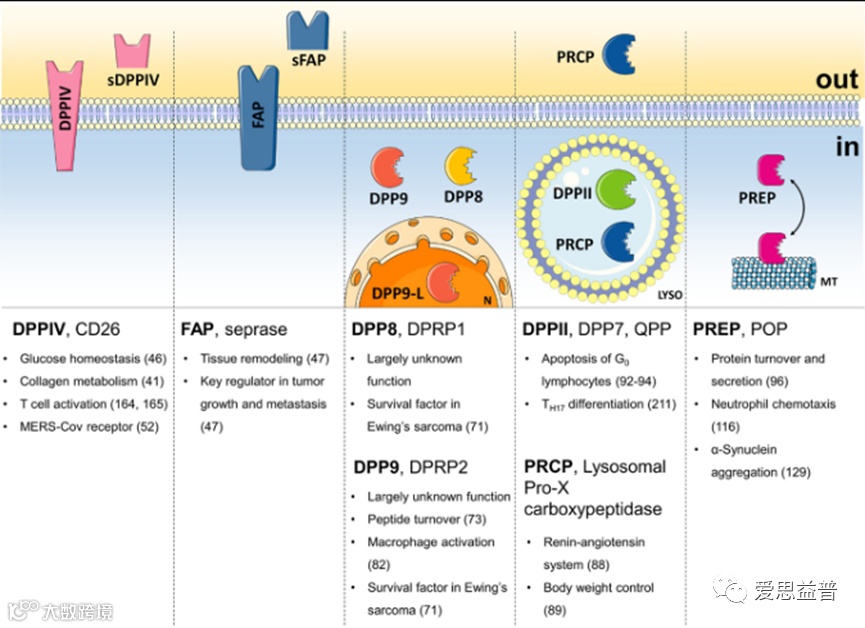
图9:二肽基肽酶家族
小结:
爱思益普团队不仅可以提供针对Protease 家族选择性生化评价体系,同时具有丰富细胞的信号通路研究,DMPK的性质分析,体内动物模型的药效评价以及神经心脏安全和体外次级药理学安全性评价(Safety panel)等服务经验,对Protease相关服务感兴趣的同仁,可以随时联系我们索取资料!

撰稿人----袁博翰
1.Paulina Kasperkiewicz.Emerging challenges in the design of selective substrates,inhibitors and activity-based probes for indistinguishable Proteases. University of Science and Technology, Wyb.Wyspianskiego 27, 50-370 Wroclaw, Poland. doi:10.1111/febs.14001
2. Robert J Nichols. Discovery and characterization of a novel family of prokaryotic nanocompartments involved in sulfur metabolism. Nichols, LaFrance, et al. eLife 2021;10:e59288.doi.org/10.7554/eLife.59288
3. Ben J. Davies. Serine Proteases in Rodent Hippocampus. Vol. 273, No. 36, Issue of September 4, pp. 23004 –23011, 1998. doi: 10.1074/jbc.273.36.23004
4. Sonia Verma.Cysteine Proteases: Modes of Activation and Future Prospects as Pharmacological Targets. Front. Pharmacol., 25 April 2016.Sec. Experimental Pharmacology and Drug Discovery.Volume 7 – 2016. doi.org/10.3389/fphar.2016.00107
公司介绍
截至目前,爱思益普为600家以上的国内新药研发机构提供服务,得到客户广泛好评;每年有数百个项目进行新药临床研究(IND)申报,多个项目通过NMPA的现场核查。



