
趋化因子是一类结构相似,分子量约8~10kDa的小分子分泌性蛋白,在稳态和炎症状态下引导细胞迁移。趋化因子作为细胞迁移的主要调节因子,对基本的生命过程至关重要,包括生命早期的胚胎发育、免疫监视、宿主防御和伤口修复,以及随年龄而来的疾病[1,2]。此外,趋化因子诱导细胞定向迁移,细胞因趋化因子吸引,沿着趋化因子浓度增加的信号向趋化因子开始处的迁移。
在功能上,趋化因子通常因其表达方式和生物学功能分为炎症趋化因子和稳态趋化因子。然而,一些趋化因子因具有稳态和炎症功能被称为双重趋化因子。趋化因子超家族的主要任务是协调健康和疾病中的细胞迁移和归巢。值得注意的是,趋化因子及其受体通常具有高度混杂的关系:单个趋化因子与多个趋化因子受体结合,而单个趋化因子受体与多个配体相互作用[3](图1)。配体在相应的趋化因子受体上结合并促进其细胞质环和尾部的结构变化,从而催化GDP与GTP在异三聚体G蛋白的α亚基上交换。然后,α和βγ亚基解离并与细胞效应酶结合,产生第二信使cAMP或IP3,进而激活不同的信号通路,触发下游反应[4]。
几项研究表明,与许多其他GPCRs一样,CC和CXC趋化因子受体都在细胞表面的功能信号区域经历同二聚或异二聚化[5],二聚体或寡聚体中的受体聚集显着提高趋化因子反应的敏感性和强度。趋化因子受体因生理和病理条件下的多效性作用而脱颖而出,它是药物开发的关键靶点。我们需要重点关注趋化因子受体信号传导及其在健康和疾病中的功能意义。

Fig1. Overview of chemokine family
图1. 趋化因子家族总览[3]
CXCR4是一种具有七个跨膜结构域的G蛋白偶联受体,首次在外周血白细胞中被发现,并在多种细胞中高度表达,包括淋巴细胞、内皮细胞、上皮细胞和造血干细胞、间质成纤维细胞和癌细胞。CXCR4在多种生理过程中发挥关键作用,如神经发生、生殖细胞发育和血管形成等[6-8]。CXCR4的基础表达主要受核呼吸因子1 (Nuclear Respiratory Factor 1 ,NRF-1)和核转录因子Yin-Yang 1 (YY1)的调节,前者促进受体转录,而后者负调节[9,10]。CXCR4响应不同的信号分子以增加转录表达,如第二信使(钙,环腺苷酸),细胞因子(IL-2, IL-4, IL-7, IL-10, IL-15, TGF-β)和生长因子(bFGF, VEGF)。然而,在TNF-a、INF-γ和IL-1β等细胞因子存在的情况下CXCR4的表达下调[11]。

Fig2. Canonical two-site model of receptor: chemokine recognition
图2.受体的典型双位点模型:趋化因子识别[12]
注:CRS为识别位点
CXCR4的表达经历磷酸化、糖基化、泛素化和硫酸盐化阶段,从而调节受体的细胞内分布、信号传导和功能。CXCL12是CXCR4的主要特异性配体,是一种控制造血细胞运输和淋巴组织结构的稳态趋化因子。CXCL12与CXCR4的结合通过两步进行。首先,CXCR4与CXCL12在胞外域联系引起受体的构象变化,从而加强趋化因子与受体的结合。然后,受体通过从Gβ/Gγ解离Gα亚基激活细胞内三聚体G蛋白,经历第二次构象变化[13]。CXCL12结合CXCR4后,促进G蛋白偶联受体激酶(GRKs)的招募,引起C末端位点特异性磷酸化,从而与β-arrestins结合。β-arrestins的募集导致CXCR4与G蛋白解耦联,并引起受体内化。在内化后,CXCR4可以被‘回收’到细胞表面,或在E3泛素连接酶AIP4介导的过程中被溶酶体降解[14]。

Fig3. Schematic diagram of main signal paths of CXCR4
图3.CXCR4主要信号通路示意图[15]
肝炎是一种肝脏炎症,可由毒素或病毒等不同类型的感染因子引起。如果不及时治疗,肝炎会导致严重的健康问题,包括肝损伤、肝纤维化和肝硬化、肝衰竭、肝癌,甚至死亡。尽管肝炎的病理生理过程尚未完全阐明,但许多研究已经证实了CXCR4及其配体的作用。在炎症性肝病中,大多数肝浸润淋巴细胞表达CXCR4,且其表达强度在肝浸润淋巴细胞中高于外周血淋巴细胞[16]。毒物性肝炎中,CXCL12/CXCR4促进CD4+和CD8+细胞向肝脏迁移,并诱导炎症聚集。非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)肝脏中CXCL12和CXCR4蛋白水平显著升高。此外,在NASH中,马洛里-登克体(MalloryDenk Bodies,MDB)是通过NFκB-CXCR4/7 (CXCR4和CXCR7)途径形成的,而形成的过程又反向参与持续的炎症反应[17]。值得注意的是,AMD3100作为CXCR4拮抗剂可以抑制CXCL12对CD4+ T细胞的趋化作用,并减少CD4+ T到达肝脏的细胞数量[18]。因此,CXCR4及其配体是NASH药物治疗的潜在靶点。
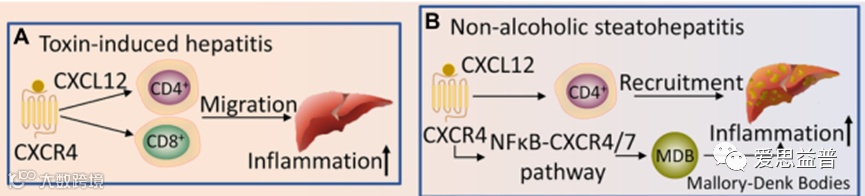
Fig4. Regulation of liver disease by CXCR4 and its ligand.
图4.CXCR4及其配体对肝病的调节作用[15]
注:A.毒物性肝炎,CXCL12/CXCR4轴促进CD4+和CD8+细胞向肝脏迁移,并诱导炎症聚集。B.CXCL12依赖CXCR4促进NASH中CD4+T细胞的募集,而NF-κB-CXCR4/7途径通过形成MDB小体进一步促进NASH的炎症反应。
癌细胞通过血液和淋巴管优先转移到特定器官,这对癌症的根除是一个巨大的挑战。与肿瘤转移密切相关的一类GPCRs是趋化因子受体。趋化因子以自分泌或旁分泌的方式局部释放到肿瘤周围区域的微环境后,在肿瘤周围和环境中增强癌细胞的活力和存活。CXCR4是包括乳腺癌、卵巢癌、黑色素瘤、前列腺癌和结直肠癌在内的23种人类癌症中表达最广泛的趋化因子受体,尽管CXCR4在许多正常组织中低表达或不表达[19]。
已有研究表明,CXCR4在正常乳腺组织中没有发现,但它在乳腺癌细胞中过度表达。CXCR4通过参与大多数乳腺癌转移的P-REX1激活Rac1。CXCR4也可能与G12/13偶联,以rhoa依赖的方式促进基底样乳腺癌细胞的转移。因此,靶向肿瘤细胞上参与CXCR4表达控制的分子或下游信号通路可以提供治疗选择。值得注意的是,IT1t,一种有效的CXCR4拮抗剂,在治疗三阴性乳腺癌方面展示了其抗肿瘤作用[20]。
前列腺癌是男性中最常见的癌症,也是发达国家男性癌症相关死亡的第二大原因。前列腺癌最常见的死亡原因不是原发性肿瘤生长,而是其扩散到其他器官,主要是骨骼[21]。癌症生物学的最新进展表明,CXCR4/CXCL12在包括前列腺癌在内的各种癌症的癌症干细胞更新和转移中发挥的关键作用[22,23]。有数据表明,前列腺癌表达的CXCR4水平比非恶性前列腺组织高35倍,这表明CXCR4表达可能是前列腺癌的诊断生物标志物。CXCR4表达与淋巴结或骨转移显著相关。骨转移性前列腺癌细胞表达CXCR4水平高于原发性肿瘤,这表明CXCR4表达可能是前列腺癌转移的有效预后标志物[24]。
世界卫生组织IV级胶质瘤,定义为多形性胶质母细胞瘤(Glioblastoma multiforme, GBM),是最常见和恶性的原发性星形细胞瘤,占成人所有脑肿瘤的60%以上[25]。GBM通常具有坏死和缺氧区域,这会增加CXCL12、MIF和CXCR4的表达,以通过GBM细胞中的MIF-CXCR4-AKT途径驱动EMT。CXCR4/CXCL12信号传导调节脑肿瘤生物学的许多其他方面,包括对放化疗的耐药性、癌细胞通过大脑的迁移、血管生成和血管祖细胞的募集[26]。这些特性表明CXCR4拮抗剂可能有助于控制这种疾病。
在许多自身免疫性疾病的炎症情况下,CXCR4在白细胞趋化过程中发挥作用,在不同类型的人类癌症中观察到CXCR4的高水平。这些研究结果表明,CXCL12/CXCR4是自身免疫性疾病的潜在治疗靶点,通过中和CXCL12和CXCR4开辟了癌症靶向治疗的新途径。

Fig5. CXCR4 signaling promotes tumor growth and organ-specific metastasis..
图5.CXCR4信号传导促进肿瘤生长和组织特异性转移[27]
结语:
以上内容表明,CXCR4及其配体在疾病和癌症中发挥关键作用。CXCL12依赖于细胞内外条件,通过激活CXCR4来精准地调节信号转导,进而参与疾病的发展。除了在炎症部位‘动员’免疫细胞外,CXCR4信号通路也调节肝脏疾病。因此,开发靶向CXCR4及其配体的药理潜力需要更好地了解它们的不同作用。
爱思益普专注于基于靶点的先导化合物筛选和优化,批量构建了新药筛选的靶点和筛选技术,致力于以高效、专业的服务,帮助新药研发企业快速有效地推进新药研发项目。我们构建了IP1、cAMP以及钙流的常规方法用于靶向GPCRs化合物的检测。
以下是CXCR4靶点常规检测方法数据展示:
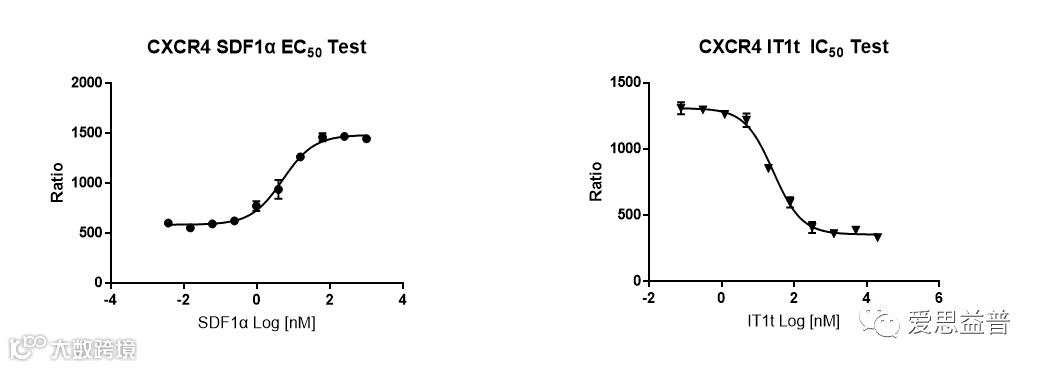
图 9. p53 reporter细胞株的构建
撰稿人----王旭莹
参考文献:
[1]Zlotnik A, Yoshie O. Chemokines: a new classification system and their role in immunity. Immunity. 2000 Feb;12(2):121-7.
[2]Yoshie O, Imai T, Nomiyama H. Chemokines in immunity. Adv Immunol. 2001;78:57-110.
[3]Yoshie O, Matsushima K. CCR4 and its ligands: from bench to bedside. Int Immunol. 2015 Jan;27(1):11-20.
[4]Zlotnik A, Yoshie O. The chemokine superfamily revisited. Immunity. 2012 May 25;36(5):705-16.
[5]Nomiyama H, Osada N, Yoshie O. Systematic classification of vertebrate chemokines based on conserved synteny and evolutionary history. Genes Cells. 2013 Jan;18(1):1-16.
[6]Lira SA, Furtado GC. The biology of chemokines and their receptors. Immunol Res. 2012 Dec;54(1-3):111-20.
[7]Richardson BE, Lehmann R. Mechanisms guiding primordial germ cell migration: strategies from different organisms. Nat Rev Mol Cell Biol. 2010 Jan;11(1):37-49.
[8]Agarwal U, Ghalayini W, Dong F, Weber K, Zou YR, Rabbany SY, Rafii S, Penn MS. Role of cardiac myocyte CXCR4 expression in development and left ventricular remodeling after acute myocardial infarction. Circ Res. 2010 Sep 3;107(5):667-76.
[9]Moriuchi M, Moriuchi H, Turner W, Fauci AS. Cloning and analysis of the promoter region of CXCR4, a coreceptor for HIV-1 entry. J Immunol. 1997 Nov 1;159(9):4322-9.
[10] Moriuchi M, Moriuchi H, Margolis DM, Fauci AS. USF/c-Myc enhances, while Yin-Yang 1 suppresses, the promoter activity of CXCR4, a coreceptor for HIV-1 entry. J Immunol. 1999 May 15;162(10):5986-92.
[11] John M. Busillo, Jeffrey L. Benovic,Regulation of CXCR4 signaling,Biochimica et Biophysica Acta (BBA) - Biomembranes,Volume 1768, Issue 4,2007, 952-963.
[12] Kufareva I, Gustavsson M, Zheng Y, Stephens BS, Handel TM. What Do Structures Tell Us About Chemokine Receptor Function and Antagonism? Annu Rev Biophys. 2017 May 22;46:175-198.
[13] Oldham WM, Hamm HE. Heterotrimeric G protein activation by G-protein-coupled receptors. Nat Rev Mol Cell Biol. 2008 Jan;9(1):60-71.
[14] Marchese A, Raiborg C, Santini F, Keen JH, Stenmark H, Benovic JL. The E3 ubiquitin ligase AIP4 mediates ubiquitination and sorting of the G protein-coupled receptor CXCR4. Dev Cell. 2003 Nov;5(5):709-22.
[15] Wang S, Gao S, Li Y, Qian X, Luan J, Lv X. Emerging Importance of Chemokine Receptor CXCR4 and Its Ligand in Liver Disease. Front Cell Dev Biol. 2021 Jul 27;9:716842.
[16] Terada R, Yamamoto K, Hakoda T, Shimada N, Okano N, Baba N, Ninomiya Y, Gershwin ME, Shiratori Y. Stromal cell-derived factor-1 from biliary epithelial cells recruits CXCR4-positive cells: implications for inflammatory liver diseases. Lab Invest. 2003 May;83(5):665-72.
[17] Liu H, Li J, Tillman B, Morgan TR, French BA, French SW. TLR3/4 signaling is mediated via the NFκB-CXCR4/7 pathway in human alcoholic hepatitis and non-alcoholic steatohepatitis which formed Mallory-Denk bodies. Exp Mol Pathol. 2014 Oct;97(2):234-40.
[18] Boujedidi H, Robert O, Bignon A, Cassard-Doulcier AM, Renoud ML, Gary-Gouy H, Hemon P, Tharinger H, Prévot S, Bachelerie F, Naveau S, Emilie D, Balabanian K, Perlemuter G. CXCR4 dysfunction in non-alcoholic steatohepatitis in mice and patients. Clin Sci (Lond). 2015 Feb;128(4):257-67.
[19] Nagarsheth N, Wicha MS, Zou W. Chemokines in the cancer microenvironment and their relevance in cancer immunotherapy. Nat Rev Immunol. 2017 Sep;17(9):559-572.
[20] Tulotta C, Stefanescu C, Beletkaia E, Bussmann J, Tarbashevich K, Schmidt T, Snaar-Jagalska BE. Inhibition of signaling between human CXCR4 and zebrafish ligands by the small molecule IT1t impairs the formation of triple-negative breast cancer early metastases in a zebrafish xenograft model. Dis Model Mech. 2016 Feb;9(2):141-53.
[21] Jung SJ, Kim CI, Park CH, Chang HS, Kim BH, Choi MS, Jung HR. Correlation between Chemokine Receptor CXCR4 Expression and Prognostic Factors in Patients with Prostate Cancer. Korean J Urol. 2011 Sep;52(9):607-11.
[22] Chatterjee S, Behnam Azad B, Nimmagadda S. The intricate role of CXCR4 in cancer. Adv Cancer Res. 2014;124:31-82.
[23] Gladson CL, Welch DR. New insights into the role of CXCR4 in prostate cancer metastasis. Cancer Biol Ther. 2008 Nov;7(11):1849-51.
[24] Chen Q, Zhong T. The association of CXCR4 expression with clinicopathological significance and potential drug target in prostate cancer: a meta-analysis and literature review. Drug Des Devel Ther. 2015 Sep 7;9:5115-22.
[25] Rock K, McArdle O, Forde P, Dunne M, Fitzpatrick D, O'Neill B, Faul C. A clinical review of treatment outcomes in glioblastoma multiforme--the validation in a non-trial population of the results of a randomised Phase III clinical trial: has a more radical approach improved survival? Br J Radiol. 2012 Sep;85(1017):e729-33.
[26] Guo X, Xu S, Gao X, Wang J, Xue H, Chen Z, Zhang J, Guo X, Qian M, Qiu W, Li G. Macrophage migration inhibitory factor promotes vasculogenic mimicry formation induced by hypoxia via CXCR4/AKT/EMT pathway in human glioblastoma cells. Oncotarget. 2017 Jun 27;8(46):80358-80372.
[27] Luker GD, Yang J, Richmond A, Scala S, Festuccia C, Schottelius M, Wester HJ, Zimmermann J. At the Bench: Pre-clinical evidence for multiple functions of CXCR4 in cancer. J Leukoc Biol. 2021 May;109(5):969-989.
公司介绍



