
爱求索、思新异、益中国、普创新。
为鼓励大家跟踪前沿专利和文献,工作中保持积极学习的心态,员工自发组织了《每周一文》系列文章,旨在阅读并梳理文章中的关键技术和结果,结合公司的新药研发平台,寻求拓展,希望能助力更多创新的研究团队,支持“产学研医药”大融合。

今年特大的药物转让新闻,莫过于TAK-279,一款基于计算机药物设计优化的TYK2抑制剂,也是多种严重炎症和自身免疫性疾病的重点开发方向[1]。TAK-279是一种口服的TYK2选择性变构抑制剂,被Takeda(武田制药)认为在银屑病以及其他多种免疫介导的疾病(包括炎症性肠病、银屑病关节炎和系统性红斑狼疮)中表现出最佳疗效、安全性和便利性。在1期临床研究中,TAK-279显示出良好的耐受性、探索性临床活性的剂量依赖性趋势、以及支持每天一次固体口服用药的药代动力学特征。针对该药物的2期临床试验正在进行中。
故事开始之前,讲一讲JAK家族中的关键成员——TYK2。(文末有惊喜)
1.1 TYK2的结构
JAK是Janus Kinase的缩写,而Janus取自罗马神话中的“两面神”雅努斯。传说中它有前后两张面孔,所以发现它的科学家们借用这个神话人物来形容JAK家族的标志性特征,即存在两个十分相似的结构域。
TYK2,其在结构上具有高度同源性,由7个不同结构域组成,从C端到N 端分别命名为JH1-JH7(图1.1)。根据JAK 家族结构域的功能差异,7个不同结构域可分成4个不同功能域:JH1(激酶结构域)是腺嘌呤核苷三磷酸活性位点所在结构域,负责底物磷酸化。JH2(假激酶结构域)与 JH1 结构相似,但缺乏催化功能,参与调控 JH1 催化活性。JH3-JH4(SH2 :同源 2 结构域)用以稳定 JAK构象。JH5-JH7 (FERM :同源结构域)。

图1.1 TYK2靶点结构示意图[2]
1.2 TYK2的功能
JAK-STAT 信号通路是细胞因子信号传导的重要途径,参与人体内细胞增殖、分化、凋亡及免疫调节等过程。TYK2 是 JAK-STAT 通路中的一种关键信号转导激酶,在传递炎症因子和免疫应答方面具有重要的作用。
白细胞介素或干扰素与受体特异性结合后导致受体二聚化,随后招募 JAK 蛋白向受体细胞质聚集并磷酸化激活 JAK。与此同时活化的 JAK 磷酸化 STAT 蛋白,STAT 形成二聚体并转运至细胞核内,与目标基因启动子结合后调节特定基因的表达[3]。
JAK 抑制剂能够与 JAK 蛋白的ATP 位点结合并抑制 JAK 的磷酸化激活,由此破坏下游的级联反应,导致自身免疫性疾病、炎症等疾病相关基因转录减少(图1.2)。
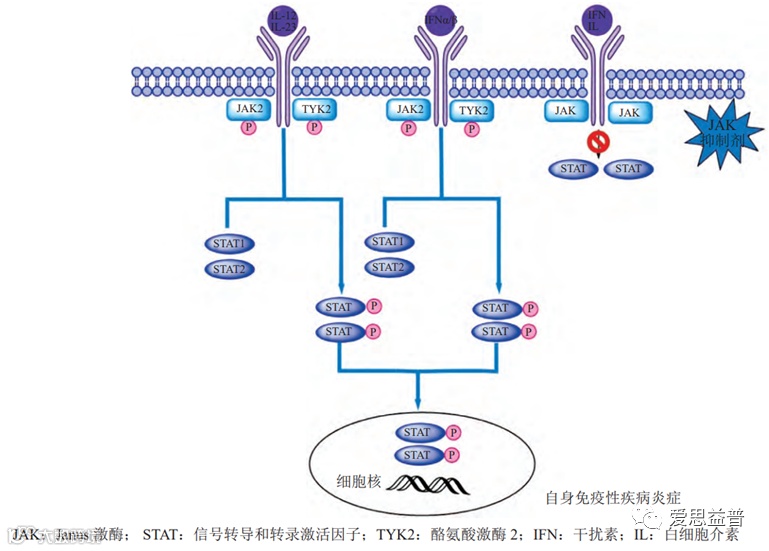
图1.2 JAK-STAT 信号通路和 JAK 抑制剂作用机理[3]
2.1 TYK2与疾病的关系
作为一种重要的信号传导激酶,相比其他类型的JAK抑制剂,TYK2所影响的通路谱更窄,由此安全性隐患更小。在迄今为止试验中,TYK2抑制剂还没有出现在其他JAK抑制剂试验中报告过的严重副反应。
TYK2 参与 IL-12、IL-23 和Ⅰ型 干扰素的信号传导,且 IL-12 和 IL-23 的异常表达会引起银屑病、类风湿性关节炎、狼疮和炎症性肠病等自身免疫性疾病[4-9]。研究发现,选择性抑制TYK2已成为治疗自身免疫性疾病的潜在策略。
2.2 靶向 TYK2 抗肿瘤药物TAK-279的研究进展
氘可来昔替尼(Deucravacitinib)也叫做BMS-986165,由百时美施贵宝公司研发,于2022年9月首获FDA批准上市,主要用于治疗成年中重度斑块状银屑病[10]。该药也是全球第一款获批上市的TYK2抑制剂,并被评为年度重磅药物分子之一。同样,TAK-279是一种有效的、选择性的TYK2(JH2)抑制剂,2023年正处于治疗癌症的2期临床试验中[11](图2.1)。
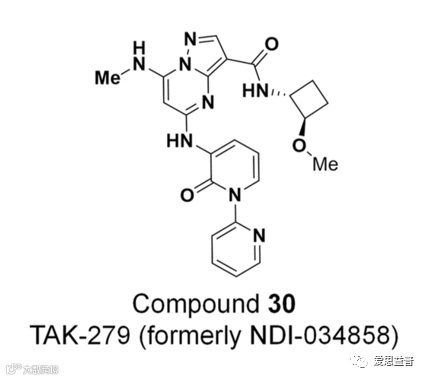
图2.1 TYK2抑制剂TAK-279的化学结构式[11]
在Silvana Leit等人2023年发表的文章 “Discovery of a Potent and Selective Tyrosine Kinase 2 Inhibitor: TAK-279”一文中详细介绍了一种强效选择性酪氨酸激酶2抑制剂—TAK-279。
文章中提到,针对化合物与JH2结构域的结合进行虚拟筛选。首先限制了空间属性,从650万个商业化合物中筛出240万个类药及类先导分子。再根据与JH2结构域的结合打分等过程,最终筛出了3个母核片段(图2.2)。
Nimbus公司使用自由能微扰技术(FEP+)计算设计的配体对TYK2的JH2和JH1结合位点的结合力,同时也需要考虑配体在溶剂和蛋白中的熵和焓效应,以及蛋白质残基的局部动力学和second-shell效应。最后再经过药物化学改造确定了候选分子NDI-034858(TAK279)的结构(图2.1)。
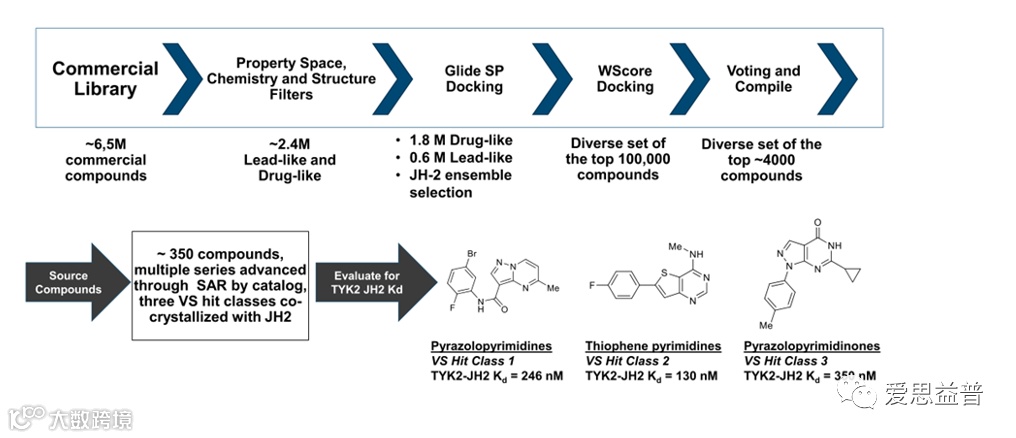
图2.2 虚拟筛选确定了3个苗头化合物母核片段[11]
文献报导了6种小分子化合物,3种JH1 TYK2小分子选择性抑制剂, 1(Brepocitinib)、2 (ropsacitinib) 3(Nimbus compound 3), 和3种JH2 TYK2 抑制剂,4(Deucravacitinib )、5(BMS-986202) 、 6a and 6b (BMS compounds)对不同激酶靶点的酶学检测结果(图2.3)。

图2.3 6种化合物对4种不同激酶靶点的酶学检测结果[11]
以下是Silvana Leit在文献中提到TAK279和Deucravacitinib两种TYK2抑制剂在不同实验方法中的IC50数值对比。对比发现在human TYK2 JH2 的实验中,TAK-279对TYK2信号通路的抑制效果更强。

图2.4 TAK-279和Deucravacitinib在不同实验中的IC50数值比较 [11]
在体内实验中,构建了大鼠佐剂性关节炎(AIA)模型,30只(n=9/组)。研究化合物30(TAK-279)在大鼠中的药效(图2.5)。

图2.5 Rat AIA Model(TAK-279)
根据Silvana Leit文章中的结果整理TYK2靶点化合物研发一体化流程路线图,其中包括酶学实验,细胞学实验,DMPK,体内模型构建等。

图2.6 根据Silvana Leit文章整理的TAK-279研发一体化流程路线图 [11]
(需要上图可添加小爱说药:beijingice123)
3.1 酶学的研究进展
在表观遗传学靶点的平台拓展和方法研究方面,爱思益普研发团队积级开展了靶向治疗中TYK2靶点的研究和分析,分别通过HTRF Assay和ADP Glo Assay检测方法验证不同浓度抑制剂非戈替尼(Filgotinib)和托法替尼(Tofacitinib)对JAK家族四个激酶靶点的抑制作用(图3.1,图3.3),其中,非戈替尼对JAK1/ JAK2/ JAK3/ TYK2激酶的抑制IC50值分别为40/45/1113/320,检测结果和文献给出的结果对比1≤Ratio≤3(图3.2)。

图3.1 Filgotinib对JAK靶点的抑制作用
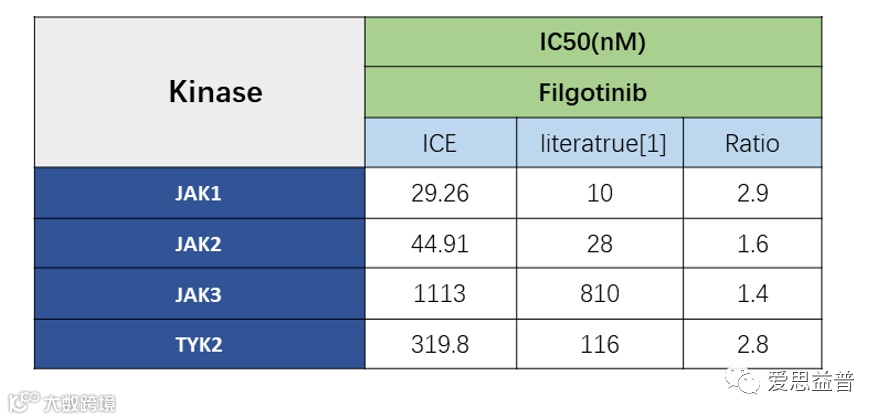
图3.2 Filgotinib抑制检测结果和文献对比
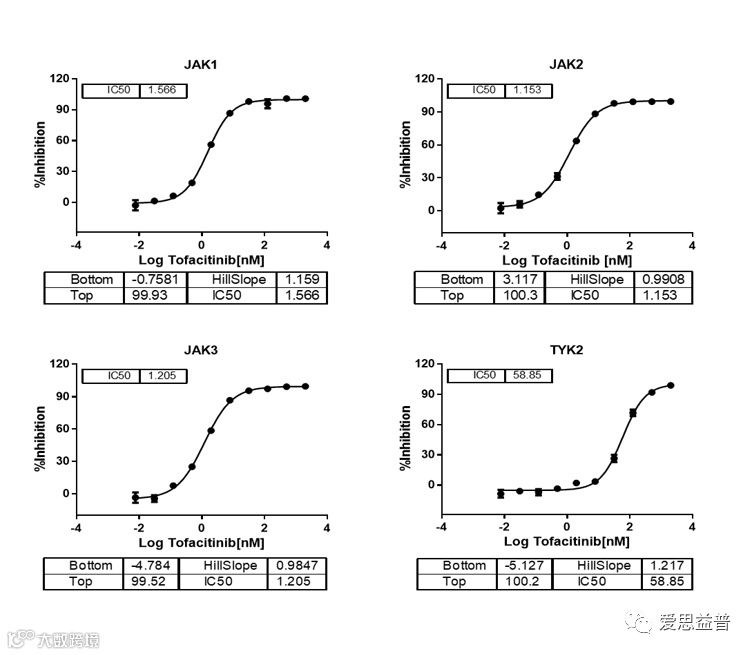
图3.3 Tofacitinib对JAK靶点的抑制作用
同时,酶学团队通过FP酶学检测方法验证不同浓度抑制剂BMS-986165对TYK2 JH2结构域的抑制作用(图3.4,图3.5)。

图3.4 BMS-986165对TYK2靶点的抑制作用
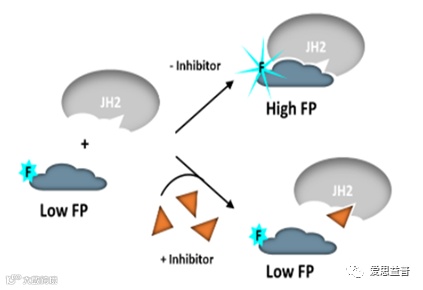
图3.5 FP酶学检测方法作用机理
3.2 细胞学的研究进展
3.2.1 报告基因的研究进展
爱思益普细胞学研发团队通过“Reporter assay”的细胞学开发方法自主研究了不同抑制剂对不同Reporter细胞体系和对应信号通路的影响,其中构建的细胞系包括IFN-α/β reporter cells、IFN-γ reporter cells、IL-12 reporter cells、IL-23 reporter Cells、IL-22 reporter Cells、IL-6 reporter Cells等。
下图是Reporter实验中干扰素和白细胞介素(IFN-α/β、IFN-γ、IL-12、IL-23、IL-22、IL-6)的信号通路和作用机理(图3.6)。
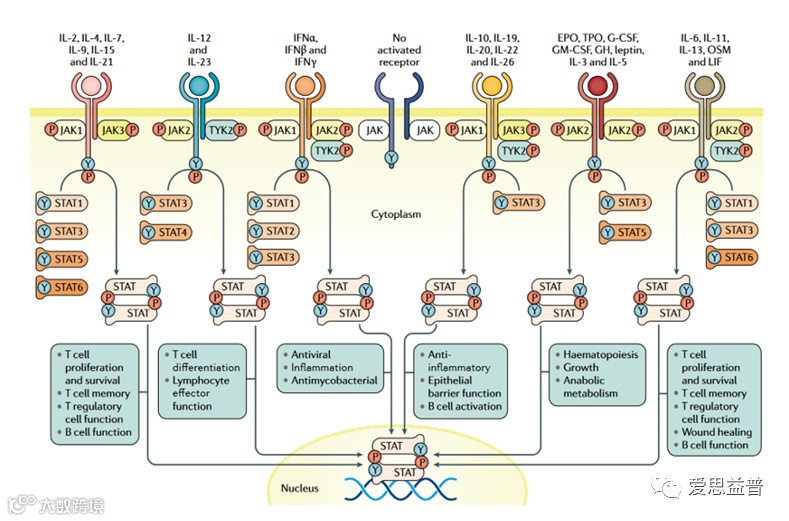
图3.6 JAK-STAT 信号通路和作用机理[12]
不同抑制剂对JAK-STAT 信号通路的检测结果图,其中包括Tofacitinib抑制剂对IL-23、IFN-α/β、IFN-γ介导信号传导的IC50值,检测其IC50值分别为0.754uM、0.023uM、0.581uM(图3.7)。

图3.7 Tofacitinib对不同细胞因子JAK-STAT 信号通路的抑制作用
同时,使用BMS986165抑制剂对IL-23、IFN-γ、IL-6、IFN-α/β、IL-22、IL-12介导信号传导的IC50值,检测其IC50值分别为0.007 uM、4.539uM、94.36uM、0.001uM、0.007uM、0.006uM(图3.8)。

图3.8 BMS-986165对不同细胞因子JAK-STAT 信号通路的抑制作用
3.2.2 原代细胞和全血的研究进展
爱思益普研发团队通过“ELISA,AlphaLIS,FACS”等方法研究了不同抑制剂对离体细胞体系和对应信号通路的影响,离体体系主要包括人外周血单个核细胞(Human peripheral blood mononuclear cells, hPBMC),人原代T细胞、人原代单核细胞以及人全血等,其中,Tofacitinib抑制剂对IL-2、IL-4、IFN-α、IL-15等介导信号传导的STAT磷酸化IC50值如下图展示(图3.9)。
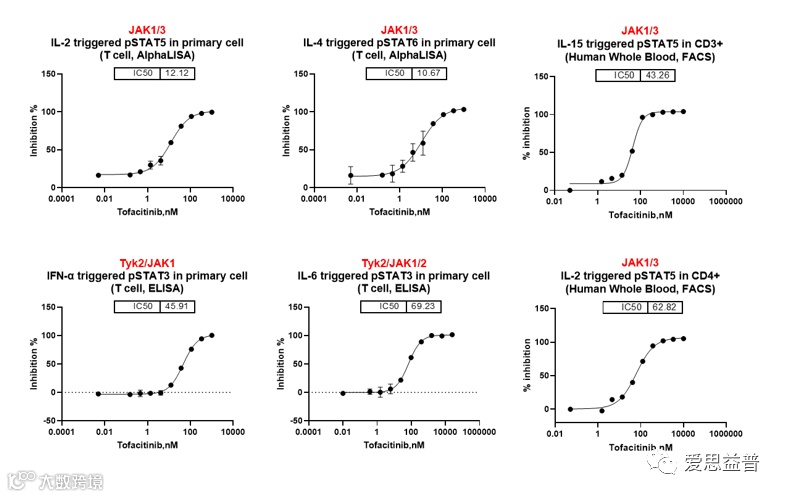
图3.9 Tofacitinib对不同离体体系JAK-STAT 信号通路的抑制作用
BMS986165抑制剂对IL-10、IFN-α介导信号传导的STAT磷酸化IC50值如下图展示(图3.10)。
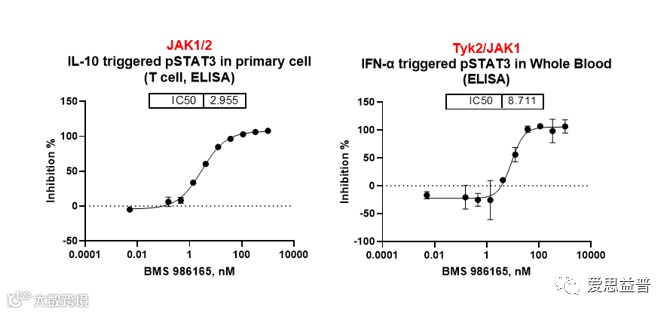
图3.10 BMS986165对不同离体体系JAK-STAT 信号通路的抑制作用
Ruxolitinib抑制剂对血小板生成素(TPO)介导信号传导的STAT3磷酸化IC50值如下图展示(图3.11)

图3.11 Ruxolitinib对不同离体体系JAK-STAT 信号通路的抑制作用
为了深化TYK2靶点一体化的研发,根据以上实验的结果,并查阅大量文献,爱思益普创新研发部在公司自有优势平台的基础上,完善并构建了TYK2靶点研发一体化流程路线图,其中包括了酶学实验,细胞学实验,药物代谢和药代动力学,体内实验,CDX模型构建等(图3.12)。

图3.12 爱思益普生物TYK2靶点化合物一体化研发流程路线图
结语:
北京爱思益普生物科技股份有限公司(ICE Bioscience InC.)专注于从先导化合物到临床前候选分子阶段,基于生化、细胞、体内模型、安全性评价等筛选技术和早期药物的机理研究,致力于建立全面的靶点筛选、优化的研究平台。
同时,爱思益普拥有一流的实验设备平台,包括HCS、Western Blot、qPCR、LC-MS、MSD等,助力靶点的精准分析和验证。此外,爱思益普可以提供数百种肿瘤及其他细胞,在实验中积累了大量的研发经验,为后期TYK2靶向药物的开发及优化提供坚实的基础。
爱思益普团队走在药品研发科技领域的前沿,深入研究靶点药物的作用机理并时刻关注着药品研发的最新动向,以优质的服务和科技创新为根本,不断优化实验方法,不断科研创新,竭诚为国内外客户提供研发和检测服务,加速中国新药研发项目的进程。
撰稿人----王海超、黄聪
参考文献:
[1] Lluís R,Luis P. Tyk2 Targeting in Immune-Mediated Inflammatory Diseases[J]. International Journal of Molecular Sciences,2023,24(4).
[2] Decker T, Meinke A. JAKs, STATs and the immune system[J].Immunobiology,1997, 198
(1/2/3): 99-111.
[3] 王力勋,朱佩钰,周金培等.选择性酪氨酸激酶2抑制剂的研究进展[J].药学进展,2022,46
(05):379-387.
[4] 余艳平,陈程,范昭泽等.用于治疗银屑病的新型选择性TYK2抑制剂氘可来昔替尼(Deucravacitinib)[J/OL].中国皮肤性病学杂志:1-11[2023-07-26].DOI:10.13735/j.cjdv.1001-7089.202211112
[5] Nogueira M, Puig L, Torres T. JAK inhibitors for treatment of psoriasis: focus on selective TYK2 inhibitors[J]. Drugs, 2020, 80(4):341-352.
[6] Hawkes J E, Yan B Y, Chan T C, et al. Discovery of the IL-23/IL-17 signaling pathway and the treatment of psoriasis[J]. J Immunol, 2018, 201(6): 1605-1613.
[7] Tektonidou M G. JAK inhibitors: promising for a wider spectrum of autoimmune diseases[J]. Lancet, 2019, 394(10214): 2047-2048.
[8] Bryan M C, Rajapaksa N S. Kinase inhibitors for the treatment of immunological disorders: recent advances[J]. J Med Chem, 2018,61(20): 9030-9058.
[9] He X R, Chen X B, Zhang H C, et al. Selective TYK2 inhibitors as potential therapeutic agents: a patent review (2015-2018) [J]. Expert Opin Ther Pat, 2019, 29(2): 137-149.
[10] Highly Selective Inhibition of Tyrosine Kinase 2 (TYK2) for the Treatment of Autoimmune Diseases: Discovery of the Allosteric Inhibitor BMS-986165. Journal of Medicinal Chemistry 2019 62 (20), 8973-8995.
[11] Silvana L, Jeremy G, Samantha C, et al. Discovery of a Potent and Selective Tyrosine Kinase 2 Inhibitor: TAK-279. [J]. Journal of medicinal chemistry,2023.
[12] Salas A, Hernandez-Rocha C, Duijvestein M, et al. JAK-STAT pathway targeting for the treatment of inflammatory bowel disease. Nat Rev Gastroenterol Hepatol. 2020;17(6):323-337.
公司介绍
截至目前,爱思益普为600家以上的国内新药研发机构提供服务,得到客户广泛好评;每年有数百个项目进行新药临床研究(IND)申报,多个项目通过NMPA的现场核查。



