
爱思益普生物化学部(ICE Biochemistry, IBC)成立于2019年2月18日, 经过近五年的发展,已经成长为涵盖从蛋白定制与产品,生物物理分析,酶学体系构建与筛选,生化机制研究,质谱分析,高通量与谱学筛选的六位一体的生物化学平台;团队经验丰富,leader 团队超过25人,平均行业从业经验超过6年,拥有1100+的ready to use的酶学靶点平台,300+的靶标蛋白产品,以及50+经SPR 验证的靶标平台等,助力国内外合作伙伴的新药研发。

聚ADP核糖聚合酶 (Poly ADP-ribose Polymerase ,PARP)是一种参与蛋白翻译后修饰的蛋白,具有多种基本功能,包括转录调节、凋亡和DNA损伤。PARP抑制剂也是第一种利用合成致死概念获批的抗癌药物,目前全球已有6款PARP抑制剂获批上市。
ADP-ribosyltransferases (ARTDs)家族有17个成员构成,可根据功能和催化活性分为五大类。第一类是DNA依赖性酶,包括:PARP1、PARP2、PARP3;第二类是端锚聚合酶:PARP5a(TNKS1)和PARP5b(TNKS2);第三类是包含RNA结合的CCCH锌指结构:PARP7、PARP12、PARP13;第四类是含有宏结构域的PARP:PARP9、PARP14、PARP15;以及归为其他的第五类:PARP4/6/8/10/11/16。

ARTD家族分类
(J. Med. Chem. 2022, 65, 7532−7560)
其中,基于其催化活性又可以分为单-ARTs、多聚-ARTs以及无活性蛋白。PARylation活性主要是由于三组氨基酸“H-Y-E”的存在,其中组氨酸(H)和酪氨酸(Y)负责NAD+合成方向,而谷氨酸是延长链所必须的;在单-ARTs中,谷氨酸被异亮氨酸、亮氨酸或酪氨酸残基所替代,不能合成聚合物,但是可以催化单个ADP-核糖的合成,当然PARP3和PARP4结构中虽然也是“H-Y-E”存在,但由于其他额外的结构特征也限制了PARP3/4的多聚-ARTs活性;PARP9和PARP13由于其催化结构域“Q-Y-T”和“Y-Y-V”不具有与NAD+结合所必须的组氨酸,使得它们失去活性。

PARP作用机制
(J. Med. Chem. 2022, 65, 7532−7560)
前面分类讲到,PARP1/2/3是一种DNA依赖性酶,这是因为PARP1/2/3会被单链断裂(single-strand breaks,SSBs)激活,从而在单链损伤处形成ADP-核糖链,作为“支架”募集DNA修复相关蛋白对DNA进行修复,防止DNA单链损伤进展到DNA双链断裂(double-strand breaks,DSBs)。BRCA1/2(breast cancer type1/2)是同源重组修复(homologous recombination repair,HRR)途径中对DNA修复发挥着关键作用的酶;在BRCA1/2缺陷的细胞中,PARP抑制剂阻止了PARP1对单链DNA的修复,从而造成DNA双链断裂,而BRCA1/2缺陷使得HR修复途径无法发挥作用,使得BRCA1/2缺陷细胞死亡。而这种作用机制被称为“合成致死”,目前上市的几个药物都是针对BRCA1/2突变的适应症的。

PARP抑制剂适应症
(doi: 10.3389/fcell.2020.564601)
在PARP抑制剂研发过程中,发现PARP抑制剂对于癌细胞的杀伤能力大于敲除PARP基因本身,这揭示了PARPi的抗癌机制不仅仅在于抑制PARP的活性。随后,研究发现PARPi可以对PARP“诱捕(Trapping)”。
在细胞中,DNA单链断裂激活PARP的催化活性,体内的NAD+与PARP活性位点结合,将参与DNA修复的蛋白募集过来对DNA进行修复,同时由于ADP-核糖链的积累,染色质变得松弛,PARP从损伤缺口脱离,恢复到失活状态;而“诱捕”,实际上是PARP抑制剂结合到PARP上后,会将PARP与受损DNA结合困住,使PARP无法脱离,其他修复的蛋白无法结合上来,DNA断裂不仅没有得到修复还变成双链断裂,最终细胞死亡。
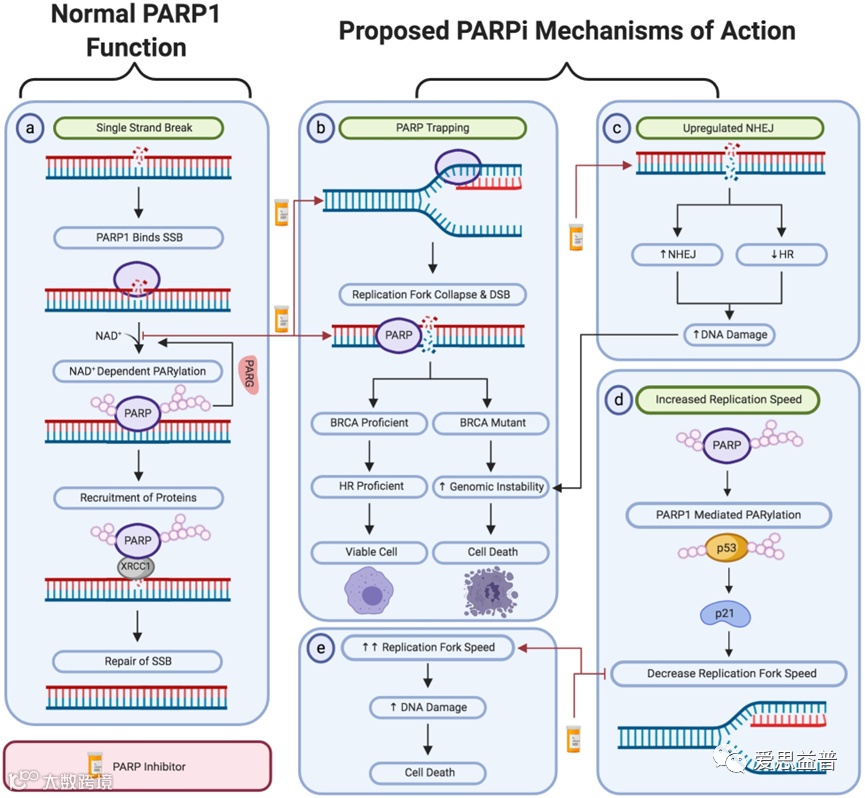
PARP抑制剂作用机制
(doi: 10.3389/fcell.2020.564601)
据统计,2022年全球PARP抑制剂市场已超过55.1亿美元,未来预计会持续上涨。而随着奥拉帕利的专利即将到期,阿斯利康高选择性PARP1抑制剂AZD5305以及AZD9574(可入脑)数据的发布,表明该靶点存在着激烈的竞争也暗示着巨大的市场前景。PARP家族亚型众多,如何开发其他亚型的抑制剂以及新的适应症也是接下来下一代抑制剂的主要方向。
今年2月1日,Ribon Therapeutics获得了Pfizer 2500万美元的投资,用于支持PARP7抑制剂RBN-2397和PARP14抑制剂RBN-3143的项目推进。PARP7是肿瘤细胞核酸感知的负调控因子,参与I型干扰素信号通路对于核酸的响应,PARP7抑制剂可以抑制细胞增殖并激活免疫系统。此外,TNKS1/2通过PARylation和靶向蛋白进行蛋白酶体降解来调控蛋白质复合物和蛋白稳定性,进而调控Wnt/β-catenin信号通路。TNKS抑制剂可以降低Axin的降解,抑制Wnt信号水平,达到肿瘤抑制的效果。
PARP抑制剂市场潜力无限,第一代PARP抑制剂选择性,适应症等都有待改进。PARP家族亚型众多,其他亚型的研究以及抑制剂开发也在不断深入,开发高选择性抑制剂以及其他亚型的抑制剂扔有着很多工作需要进行。爱思益普推出PARP panel筛选服务,针对几个重要靶点的高通量筛选以及该家族的选择性筛选都可以快速开展。

爱思益普生物化学部(IBC)打造了集蛋白纯化、酶学方法开发、抑制剂活性筛选于一体的PARPs筛选平台。同时协同细胞、ADME等平台,可支持PARPs药物活性评价的一体化研究,旨在建立全面的靶点筛选和体外生物学研究平台,满足新药研发企业对速度、效率和结果的需求,用专业的技术和高效的沟通帮助客户提高新药研发的效率。

爱思益普目前已经纯化出PARPs系列多个蛋白,蛋白团队拥有多年丰富的工作经验,每批蛋白都会经过活性验证,以保证纯度和活性,充分满足各种实验需求。


利用ELISA方法对PARP家族ADP-核糖聚合酶酶活检测。在板子上包被组蛋白,加入PARP蛋白(PARP1/2/3需加入DNA断裂单链激活)以及生物素标记的NAD,随着反应进行,PARP1会在组蛋白上形成带有生物素标记的ADP-核糖链,随后加入链和亲霉素标记的HRP以及超敏检测液来检测信号。以下是PARP家族数据展示:

ICE_PARP筛选服务
我们还拥有丰富PARP Panel选择性筛选和项目申报经验,以下是ICE在PARP家族上奥拉帕利和AZD5305测试的数据展示:


PARP在和DNA,NAD形成复合物后,随着ADP-核糖链的生成,PARP会从DNA上脱离下来。在单链断裂的DNA上标记生物素标签,PARP蛋白上带有his标签,当加入抑制剂后,PARP不会从DNA上脱离下来,从而加入对应标签抗体的供体和受体,供体受体距离很近时,两者之间可以检测到荧光能量共振转移信号。

ICE_PARP trap筛选服务

爱思益普已建立1000+的细胞平台,包括基于Flip-In, Lentiviral and Retroviral system, Neon electroporation, T-REx system, HiBiT and PPI systems 等建立的过表达和稳转细胞株,以及基于CRISPR/Cas 9 system, siRNA, shRNA建立的基因编辑细胞株。针对PARP靶点,我们推出了用于PARP抑制剂筛选的Cell Panel,包含9种癌症类型,共70个肿瘤细胞系,其中包含PARP敲除细胞系、BRCA敲除细胞系、BRCA过表达细胞系和BRCA突变细胞系、PARP抑制剂耐药细胞系和普通肿瘤细胞系。该cell panel 可用于7-14天的化合物测试,可选择单药或者联合用药测试,也可根据客户需求提供定制化的解决方案。

小结:
撰稿人----王乾
1.Maria Giulia Nizi, Mirko M. Maksimainen, Lari Lehtiö, and Oriana Tabarrini Journal of Medicinal Chemistry2022 65 (11), 7532-7560 DOI: 10.1021/acs.jmedchem.2c00281
2. Gibson, B. A.; Kraus, W. L. New Insights into the Molecular and Cellular Functions of Poly(ADP-Ribose) and PARPs. Nat. Rev. Mol.Cell Biol. 2012, 13 (7), 411−424.
3. Vyas, S.; Chesarone-Cataldo, M.; Todorova, T.; Huang, Y.-H.;Chang, P. A Systematic Analysis of the PARP Protein Family Identifies New Functions Critical for Cell Physiology. Nat. Commun. 2013, 4, 2240−2253.
公司介绍
截至目前,爱思益普为600家以上的国内新药研发机构提供服务,得到客户广泛好评;每年有数百个项目进行新药临床研究(IND)申报,多个项目通过NMPA的现场核查。



