
爱思益普生物化学部(ICE Biochemistry, IBC)成立于2019年2月18日, 经过五年多的发展,已经成长为涵盖蛋白定制与产品,生物物理分析,酶学体系构建与筛选,生化机制研究,质谱分析,高通量与谱学筛选六位一体的生物化学平台;团队经验丰富,leader 团队超过25人,平均行业从业经验超过6年,拥有1100+ready to use的酶学靶点平台,416激酶谱平台,400+靶标蛋白产品,以及50+经SPR 验证的靶标平台等,助力国内外合作伙伴的新药研发。


新药研发是人类进步的重要标志之一,也是制药产业永恒不变的主题,更是医药企业生存和发展的基石。新药研发过程需要经历“药物发现”、“临床前研究”和“临床研究”三个阶段,而研发周期长是不争的事实,导致国内制药行业承受着巨大的压力和风险。据估算,一个新药从发现到上市平均需要花费13.5年的时间,在这一过程中,大量的研发项目无法过渡到下一阶段。其中新药发现期为先导化合物的发现及优化阶段,平均耗时4.5年。
1953年DNA双螺旋结果的提出开启了分子生物学时代,使得药理学研究向前迈进了一大步,人们对药物靶点的认识深入到基因和蛋白质的分子水平,从而拉开了分子靶向高通量筛选的现代化药物发现新模式。随着分子药理学的不断深入,新的药物作用靶点、功能蛋白、基因表达变化、生物活性成分等不断地被发现,为药物筛选提供了大量新的靶点,如新的受体、酶等。这些靶点为新药筛选提供了新的信息和机会。
蛋白激酶在调节细胞代谢、生长、运动、分化和分裂方面发挥重要功能,并在许多人类疾病的形成和发展有关的信号通路中发挥着重要作用,包括癌症、血管疾病、糖尿病、炎症和退行性疾病等,这使其成为药物研发中具有吸引力的靶标。
从1980年以来,特别是基于癌症相关分子的研究中,蛋白激酶被认为是潜在的药物靶点。然而,由于细胞中高浓度的ATP、对于激酶活性调节机制认识不足、以及保守的ATP结合口袋等原因,开发与ATP位点结合的激酶抑制剂在最初被认为是一项无法完成的挑战,直到天然化合物Staurosporine(STS)的发现才打破这种局面。随着研究的不断深入,到19世纪80年代末,通过合成、鉴定和优化,筛选具有较高类药物、选择性和效力的ATP结合位点的小分子抑制剂的技术不断趋于成熟。根据小分子激酶抑制剂临床试验信息显示[1],目前正在探索大约110种新激酶作为靶点,加上大约45种已批准的激酶抑制剂靶点,共占人类激酶组的30%左右,这表明仍有大量可开发的激酶药物靶点。
一些低选择性的抑制剂已被证明通过解除多种激酶依赖途径能有效抑制癌细胞生长,但具有优越性能的高选择性药物也被越来越多的新药研发者关注。在寻找高选择性抑制剂的过程中,激酶谱筛选成为一个重要的鉴定方法。激酶谱筛选是激酶抑制剂选择性评价的重要标准。
激酶谱分析旨在确定一种化合物对大量激酶的特异选择性。因此激酶谱检测方法适用于各种激酶,并且不受检测方式和化合物的干扰。在药物研发过程中最主要的问题就是激酶选择性问题,激酶抑制剂除了靶向激酶以外,还会同时抑制其他一些非靶向激酶,并引起细胞毒性,因此在化合物改造过程中会增加激酶谱检测。
目前高通量筛选已经成为药物研发的重要工具。激酶谱筛选可以为研究者提供快捷明确的结果展示。第一,激酶谱筛选可以在药物研究的早期阶段为研究者提供明确的有作用的靶点。第二,激酶谱筛选可以用来研究化合物的选择性。
爱思益普构建的激酶谱中的每一个激酶都是经过酶浓度滴定、ATP的米氏常数(Km)滴定、底物浓度滴定以及其特异性抑制剂IC50检测等确定最佳反应条件的。抑制剂IC50具有稳定性以及和文献的一致性。传统的生化激酶分析是一个成熟的市场,我司考虑客户检测过程中的价格和服务的平衡,在筛选和排序方面进行了优化,建立多种激酶谱筛的模式,包含CDK Kinase Panel、TK Kinase Panel、80 Kinase Panel、217 Kinase Panel、330 Kinase Panel、416 Kinase Panel。


细胞周期蛋白依赖性蛋白激酶(Cyclin-dependent kinases,CDK)家族的成员最初被描述为丝氨酸/苏氨酸特异性蛋白激酶,由细胞周期蛋白表达激活,以驱动真核细胞周期。在激酶组的CMGC分支中,现有20种蛋白质被认为是CDK家族的成员[2]。CDK是主要的细胞调节因子,可与周期蛋白结合形成周期蛋白-CDK复合物,从而使数百种底物磷酸化,调控分裂间期和有丝分裂进程。各类细胞周期蛋白的活性异常,可使癌细胞增殖不受控制,导致癌症的发生与发展[3]。因此我司推出了CDK Kinase Panel,主要针对CDK家族激酶抑制剂的靶点特异性评价。


TK Kinase Panel中的76个靶点均为酪氨酸激酶,超过半数成员是受体酪氨酸激酶(receptor tyrosine kinase,RTK),其余成员多在细胞膜附近发挥功能。受体酪氨酸激酶在多种细胞过程中发挥重要作用,包括生长、运动、分化和代谢。所有的受体酪氨酸激酶都具有相似的蛋白质结构,包括细胞外配体结构域、单个跨膜螺旋结构域和细胞内区域。酪氨酸激酶信号转导失调会导致许多人类疾病,尤其是癌症[4]。我司建立了TK Kinase Panel,主要用于评价抑制剂对TK家族激酶的特异性。


在寻找高选择性抑制剂的过程中,激酶谱筛选成为一个重要的鉴定方法,激酶谱筛选是激酶抑制剂选择性评价的重要标准。我司从TK、TKL、STE、CMGC、AGC、CAMK和CK1家族中挑选出各个激酶家族主要成员,组成80 Kinase Panel。本产品成本低,用于激酶抑制剂的初步评价。


在80 Kinase Panel的基础上增加了野生型激酶数量到217 Kinase Panel中,本产品包含的是各家族主要的野生激酶,主要用来评价化合物的选择性。


在217 Kinase Panel的基础上增加野生型激酶数量,形成330 Kinase Panel,满足更加全面的对化合物选择性评价。


在330 Kinase Panel的基础上增加了86个常见突变激酶组成的416 Kinase Panel,更好的支持化合物选择性评价中对突变激酶的考量。
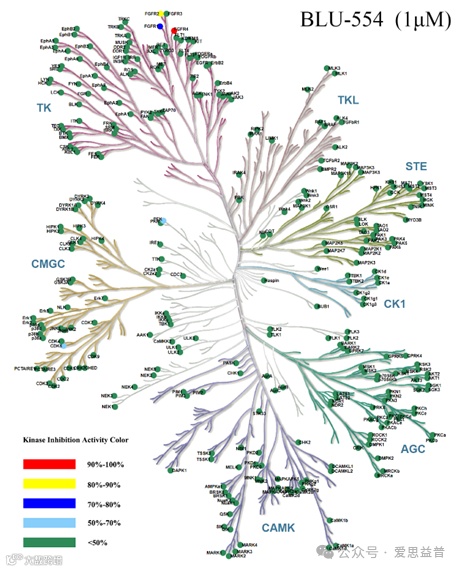

目前Kinase Panel的应用场景可以分为三类:激酶类抑制剂、非激酶类抑制剂和未确定靶点药物的靶点筛选。作为最广泛的激酶谱应用场景,激酶类抑制剂在早期体外研究需要对化合物的选择性进行检测来确定化合物的作用路径及机理,确定是高选择性抑制剂还是多靶点抑制剂,在新药申报时也需要选择性分析数据的支持,对于科研客户发表相关文献时激酶谱数据也是非常重要的一项指标。非激酶类抑制剂对于一些药物安全性筛选是一个非常快捷的考核数据。对于未确定靶点的药物筛选来说,可以设置相对较高的测试浓度。
小结:
谱中靶点全部为人源靶点,数据值得信赖。所有靶点均采用功能性方法分析,可以有效减少假阴性和假阳性的概率。检测数据全面支持中美申报,科研端同多个激酶抑制剂课题组达成长期合作,有多篇相关文章发表。作为国内最大的激酶谱供应商,ICE 谱筛业务部将继续以专业,高效的测试服务支持药物研发和科研研究工作。
撰稿人----刘志宇
[1]Attwood M M, Fabbro D, Sokolov A V, et al. Trends in kinase drug discovery: Targets, indications and inhibitor design[J]. Nature Reviews Drug Discovery, 2021, 20(11): 839-861.
[2]Wood D J, Endicott J A. Structural insights into the functional diversity of the CDK–cyclin family[J]. Open biology, 2018, 8(9): 180112.
[3]潘剑锋,尚方正,马荣等. CDK、CKI与周期蛋白在细胞周期进程中的调控机制研究进展 [J/OL]. 生物工程学报, 2023,1-31.
[4]Du Z, Lovly C M. Mechanisms of receptor tyrosine kinase activation in cancer[J]. Molecular cancer, 2018, 17: 1-13.
公司介绍
北京爱思益普生物科技股份有限公司2010年成立,专注于从靶点发现验证、先导化合物筛选、优化到临床前候选分子阶段的创新药一体化生物学服务平台,在肿瘤,免疫,心血管,中枢神经系统、代谢等疾病领域的生物学和药理学研究技术,打造创新型CRO+的探索者。爱思益普关注新药研发企业对质量、速度、效率和成本的需求,用专业的技术和高效的沟通帮助客户提高新药研发的效率。同时支持国家“产学研”战略,桥接科研、临床和企业,提供全面创新型生物学技术支持与合作。
爱思益普建立的技术平台包括:
1.基于靶点的药物筛选平台:建立了超过120种离子通道,160多种GPCR,超过1200种激酶和酶学靶点以及40多核受体筛选细胞系及验证方法,自研纯化了400余种高纯度靶标蛋白并通过活性验证测试,构建500余株耐药株、报告系统、稳转和基因编辑细胞系,涵盖了大部分成药性靶点。
2.体外和体内药效筛选评价平台:包括肿瘤免疫,心血管,中枢神经系统基于细胞、组织或动物模型的药效学评价。
3.早期成药性筛选评价平台:包括早期ADME和PK研究,早期药物脱靶效应筛选(hERG,safety panel,激酶谱等)
可支持小分子、抗体、ADC、PROTAC、小核酸等不同类型的药物筛选及生物学服务支持。
爱思益普于2022、2023连续两年完成两轮过亿元融资,在北京、上海、徐州、贵阳、新加坡、波士顿等地设有实验室和商务中心,目前实验室面积超过17000平方米,近500名员工,仪器设备投入超过1.5亿元。爱思益普建立了强大的技术团队,员工中博士占比超10%,硕士以上占比超过45%。2人入选北京市“海聚工程”海外高层次人才及北京市特聘专家;亦庄“亦麒麟”创业领军人才。是国家高新技术企业,中关村高新技术企业。2016年被认定为北京经济技术开发区“企业研发机构”和“公共技术服务平台”;2018年获得“德勤-亦庄高科技高成长20强”;2021年获北京市科委平台重大项目支持;2021年被认定为北京市企业科技研究开发机构;2022年获得北京市“专精特新”中小企业。2023完成B+轮融资,公司持续加强数字化及体系化建设,员工人数增长至近500人。
截至目前,爱思益普为1000家以上的国内新药研发机构提供服务,得到客户广泛好评;每年有数百个项目进行新药临床研究(IND)申报,各种靶标和疾病领域研究项目超1500项,多个项目通过NMPA的现场核查。



