
爱思益普生物化学部(ICE Biochemistry, IBC)成立于2019年2月18日, 经过近五年的发展,已经成长为涵盖从,蛋白定制与产品,生物物理分析,酶学体系构建与筛选,生化机制研究,质谱分析,高通量与谱学筛选的六位一体的生物化学平台;团队经验丰富,leader 团队超过25人,平均行业从业经验超过6年,拥有1100+的ready to use的酶学靶点平台,300+的靶标蛋白产品, 以及50+经SPR 验证的靶标平台等,助力国内外合作伙伴的新药研发。


大鼠肉瘤RAS是第一个被发现的人类肿瘤基因,同时也是人类癌症中最常见的突变癌基因。Harvey和Kirsten等人在60年代分别发现了类似于RSV的逆转录病毒携带的老鼠肿瘤基因HRAS和KRAS,Weinberg等于1982年在人类膀胱癌细胞T24/EJ中也发现了HRAS,第二年,RAS家族的第三个成员NRAS在神经母细胞瘤细胞系中被发现。RAS基因被认为是肿瘤中最常见的突变基因之一,存在于约30%的人类癌症中,其中95%属于KRAS突变。
KRAS有两个拷贝,KRAS1和KRAS2,分别位于位于染色体6p11-12和12p11.112.1上。KRAS1是个假基因,不能被转录成RNA,KRAS2能够转录并翻译成蛋白质,具有生物学活性,KRAS转录时由于第四号外显子有两种不同的剪接方式,所以会获得两种KRAS变体:KRAS4A和KRAS4B,KRAS4B的表达量要明显高于KRAS4A,所以KRAS这个术语一般用来表示KRAS4B。KRAS蛋白产物由两个结构域组成,N端的催化结构域(G-domain)和C端的高变区(HVR)。催化结构域是一个高度保守的区域,具有高度的同源性,它包含p-loop,switch I和switch II区域,该结构域促进GDP-GTP的交换,起到GDP-GTP开关的作用。

(Parikhet al. Journal of Hematology & Oncology (2022) 15:152)
KRAS编码一个小GTP酶,属于RAS超蛋白家族。在正常细胞中,KRAS蛋白在on和off两种状态之间转换,失活和激活的两种状态受到两类因子的调节:鸟嘌呤核苷酸交换因子(GEFs)与KRAS结合,催化KRAS与GTP的结合。GTP酶激活蛋白(GAPs)能够促进与KRAS结合的GTP水解成为GDP,从而抑制KRAS的激活。
当配体与上游受体结合,如表皮生长因子(EGF)与其受体(EGFR)相互作用时,导致受体二聚化,随后发生自磷酸化,磷酸化的受体与一个接头蛋白Grb2结合,该复合体招募SOS1到质膜上,质膜上的SOS1取代RAS中的GDP,允许RAS与GTP相互作用,GTP与RAS的结合导致switch I和switch II的改变,从而激活RAS。
KRAS的激活下游三条信号通路:MAP激酶信号通路,P13K-AKT-mTOR通路,肿瘤侵袭和转移诱导蛋白1 (TIAM1-RAC)和ras相关蛋白(RAL)通路。MAPK途径由RAS,RAF,MEK和ERK磷酸化组成,调控细胞周期和细胞增殖,这是RAS的主要下游信号通路,RAS的激活和二聚化导致构象的变化,允许RAF分子的结合和磷酸化,ERK作为MAPK途径的最后一种酶,易位到细胞核并激活各种转录因子,促进细胞的增值和分化。另一条信号通路是P13K被GTP-RAS复合物激活,导致磷脂酰肌醇4,5-二磷酸(PIP2)磷酸化为磷脂酰肌醇4,5-三磷酸(PIP3),PIP3磷酸化AKT,最终激活下游的mTOR,导致细胞存活并抵抗凋亡。
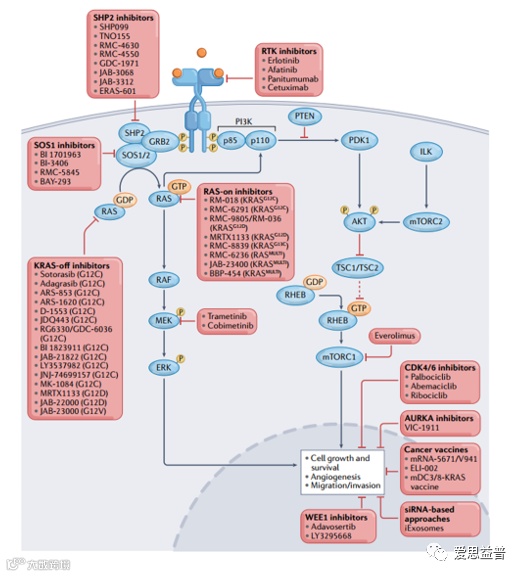
KRAS突变以不同比例发生在各种恶性肿瘤中,发病率在胰腺癌中最高(>85%),其次是结直肠癌(43%),非小细胞肺癌(30%)等。KRAS突变主要发生在第12位和第13位密码子上,以及少量的突变发生在61位密码子上。各类突变以不同的比例出现在不同的肿瘤类型中。KRAS突变大都影响了KRAS内在GTPase的活性,导致激活的KRAS无法将GTP水解为GDP,KRAS被锁定在激活的状态,不断激活下游信号通路,导致肿瘤的发生。

(Zhuet al. Molecular Cancer (2022) 21:159)
虽然KRAS是最早发现的癌症突变基因,但是几十年来关于KRAS的抑制剂进展缓慢,KRAS又被称为“不可成药靶点”,主要的原因有以下几点:1.KRAS蛋白表面光滑,近乎球体,缺乏药理学上可操作性的小分子结合口袋。2.KRAS与GTP具有皮摩尔级别的亲和力,GTP在细胞内的浓度很高。还有一个原因是KRAS蛋白与GTP的结合位点在不同的突变体之间存在差异,这进一步增加了KRAS抑制剂设计的复杂性。
近年来,关于KRAS抑制剂的研究获得突破。2021年,美国FDA加速批准选择性KRAS G12C抑制剂sotorasib(AMG510)上市,这是全球首个获得批准的靶向KRAS突变的肿瘤治疗药物。2022年底,adagrasib(MRTX849)获批上市。两款抑制剂都是靶向KRAS G12C非活性状态,化合物占据KRAS的switch II,阻止GEFs将GDP替换为GTP,从而抑制了KRAS G12C的激活。

(Parikhet al. Journal of Hematology & Oncology (2022) 15:152)

爱思益普打造了集蛋白纯化、KRAS与上下游蛋白相互作用检测、小分子与KRAS突变体亲和力分析及细胞增值检测等平台。我们目前拥有齐全的KRAS突变体(G12D/C/V/R/S,G13D/C,Q61H),以及RAS蛋白超家族的另外两个成员HRAS和NRAS,稳定的酶学、生物物理学和细胞学检测体系,旨在助力新药发现,促进新药研发进程。

爱思益普可提供齐全的KRAS突变体(G12D/C/V/R/S,G13D/C,Q61H),HRAS、NRAS及上下游相关SOS1和cRAF等重组蛋白,每批蛋白都经过活性验证,保证纯度和活性,可提供GDP-loaded形式,充分满足各种实验需求。
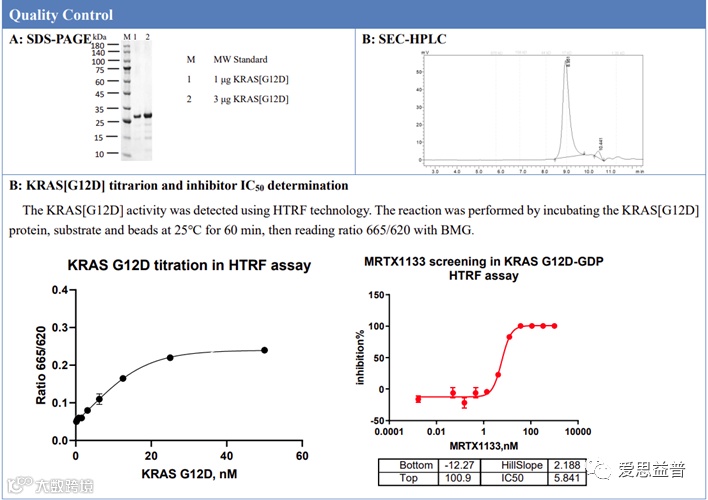
图 1,KRAS G12D蛋白质控数据(IBC)

KRAS可以与SOS1,SOS2等鸟苷酸交换因子(GEF)结合。激活的KRAS可以与下游cRAF结合启动下游通路。爱思益普通过HTRF的方法检测KRAS与SOS1,SOS2和cRAF的结合程度,反应小分子对KRAS的抑制。

图 2,KRAS HTRF Binding assay (IBC)

KRAS结合鸟苷酸交换因子SOS1后,GDP会脱落下来,并允许GTP与KRAS结合,进而激活KRAS。爱思益普通过两种方法检测小分子对KRAS NEA的抑制。第一种方法是荧光标记的BODIPY-GTP在SOS1的作用下与携带有标签的KRAS结合,通过TR-FRET方法检测KRAS与BODIPY-GTP的结合情况。第二种方法是携带有标签的KRAS在SOS1的作用下由无活性的GDP状态转换为有活性的GTP状态,激活后的GTP KRAS与下游携带有标签的cRAF结合,通过HTRF的方法检测GTP KRAS与cRAF的结合情况,间接反应KRAS的交换程度。

图 3,SOS1 介导的鸟苷酸交换实验(IBC)

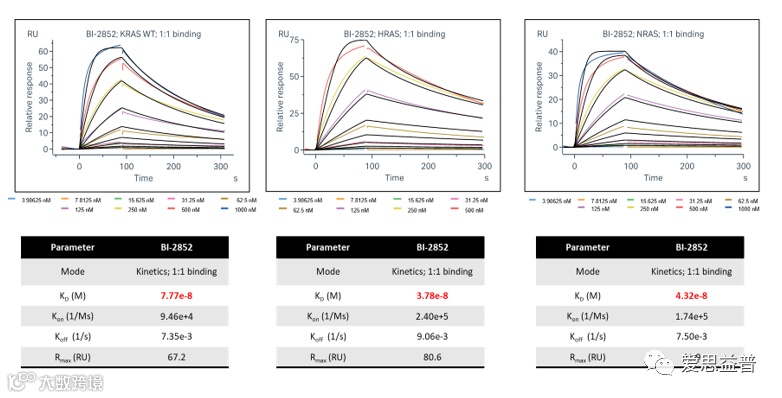
IBC生物物理团队可以提供针对KRAS不同突变体,NRAS以及HRAS与小分子结合的SPR评价方法,包括GDP与GTP两种结合状态。


Ba/F3细胞是一株来自小鼠的前B细胞系,其独特性在于其体外增殖依赖于小鼠白介素3(mIL3)的刺激。酪氨酸激酶在该细胞中几乎不存在,因此为酪氨酸激酶受体融合表达的稳转株的建立提供了一个纯净的背景。爱思益普贵州团队已构建33种KRAS突变相关的Ba/F3稳转细胞系,可以实现在细胞水平上评价抑制剂对不同Kras突变的敏感性,也为肿瘤体内模型的构建提供不同的稳转细胞株;

图 4,BaF3 原理示意图
表 1,化合物在不同kras 突变株中的抑制结果 (ICE,贵州)

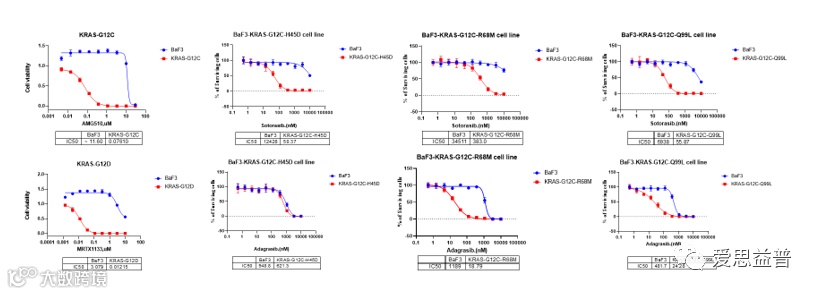
图 5,化合物在不同kras 突变株中的抑制图 (ICE,贵州)
小结:
爱思益普团队不仅可以提供针对RAS 家族尤其是KRAS 不同突变的生化评价体系,同时具有丰富细胞的信号通路研究,DMPK的性质分析,体内动物模型的药效评价以及神经心脏安全和体外次级药理学安全性评价(Safety panel)等服务经验,对RAS相关服务感兴趣的同仁,可以随时联系我们索取资料!
撰稿人----孙康、覃艳艳
参考文献:
1.M. Reck et al. Targeting KRAS in non–small cell lung cancer: recent progress and new approaches. Annals of Oncology. 2021;9(32) P1101-1110.
2.Dipesh Uprety, Alex A. Adjei. KRAS: From undruggable to a druggable Cancer Target. Cancer Treatment Reviews. 89 (2020) 102070.
3.Wenjuan Ning et al. A Breakthrough Brought about by Targeting KRASG12C: Nonconformity Is Punished. Cancers2022, 14, 390.
4. Salman R. Punekar et al. The current state of the art and future trends in RAS-targeted cancer therapies. ClinicAl OncoloGy. 19(2022).
5.Kaushal Parikh et al. Drugging KRAS: current perspectives and state-of-art review. Journal of Hematology & Oncology (2022) 15:152.
6. Zhu et al. Targeting KRAS mutant cancers: from druggable therapy to drug resistance. Molecular Cancer (2022) 21:159.
公司介绍
截至目前,爱思益普为600家以上的国内新药研发机构提供服务,得到客户广泛好评;每年有数百个项目进行新药临床研究(IND)申报,多个项目通过NMPA的现场核查。



