
乳腺癌是全球女性最常见的恶性肿瘤之一,每年约有170万女性被诊断患有乳腺癌,全世界有超过50万人死于乳腺癌[1]。浸润性癌症是乳腺癌中最常见的类型,与传统的手术、化疗、放疗相比靶向治疗乳腺癌得到了医药行业更多的关注。
MX-1细胞是一种与乳腺癌相关的细胞系,有乳腺癌肿瘤许多的生理特征,它在研究乳腺癌的发病机制和治疗策略中具有重要价值,因此MX-1是一种十分有用的临床前CDX模型。通过对MX-1细胞系的研究,可以探索出乳腺癌治疗方法和药物靶点,开发出新的治疗策略,为患者提供更有效的治疗方案[2]。
目前爱思益普已具备成熟的MX-1 CDX模型,已为制药企业和科研机构 提供了多次高品质的服务。

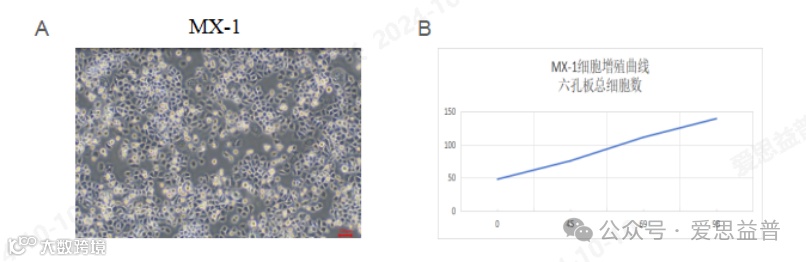
图1:MX-1体外数据:A. 接种前MX-1细胞照片;B.MX-1细胞增值曲线
爱思益普使用MX-1 CDX模型已为多家制药企业及科研机构提供了稳定的模型数据。


图2:MX-1体内数据。A. 给药测试后的肿瘤体积变化情况。B. 给药测试后的体重变化情况;C. 肿瘤重量图。D. 肿瘤照片图;E. TGI (%) 、T/C (%) 和p值 。
小鼠模型是研究与评估肿瘤免疫治疗的常用模型,在构建MX-1皮下肿瘤模型方面(图1),我们通过将MX-1乳腺癌细胞注射到裸鼠皮下,形成肿瘤,进而研究肿瘤的生长特性和药物的抗肿瘤效果。本次实验我们设立阳药组 (Positive Control-50 mpk),抑制MX-1人乳腺癌细胞的生长,显著降低了肿瘤体积,通过肿瘤体积变化、小鼠体重变化和瘤重等,计算TGI (%)、T/C (%) 和RTV等结果,结果显示,Positive Control (50 mg/kg) 能够显现出一定的抗肿瘤活性(图2)。
1. 乳腺癌细胞中的缺氧诱导因子-1 (HIF-1)是一种新的抗肿瘤靶点[3], HIF-1是一种异二聚体蛋白[4],由氧调节的HIF-1α亚基和组成性表达的HIF-1β亚基组成[5]。缺氧诱导因子-1 (HIF-1)是负责癌细胞从氧化磷酸化(OXPHOS)到糖酵解的代谢重编程的一个关键转录因子,在氧气充足的条件下(常氧),HIF-1α蛋白不断被蛋白酶体降解,半衰期不到十分钟。HIF-1α的快速翻译后降解涉及氧气“传感器”-HIF 丙lyl-羟化酶(PHD1、PHD2 和 PHD3),它们对HIF-1α蛋白进行羟化,从而使von Hippel Lindau(pVHL)泛素E3连接酶复合物将HIF-1α靶向蛋白酶体。随着肿瘤细胞的发展,支持血管往往受到限制,无法满足组织灌溉的需要,导致氧气供应不足(缺氧)。当 PO2下降时,PHDs受到抑制,导致HIF-1α的稳定性增加,从而激活转录因子HIF-1。一旦稳定下来,HIF-1α就会转移到细胞核中,与HIF-1β 和辅助因子相互作用,结合特定的 DNA 序列,即低氧反应元件(HRE)。HIF-1 激活后能改变1-2%的基因组,以适应PO2和营养物质供应的减少。HIF-1 诱导的基因包括参与自噬、呼吸减少、糖酵解增加、pH 值调节、红细胞生成、血管舒张、血管生成、迁移/侵袭的基因,并通过上诉方式增强肿瘤细胞的存活、增殖、转移能力,因此开发药物干预HIF-1是一条抗肿瘤有效途径[6-7]。
2. 糖基化是细胞中蛋白质和脂质最常见的共翻译或翻译后修饰之一,超过 50% 的已知蛋白质序列可能被糖基化。细胞表面糖基化的修饰发生在致癌过程中,这是已知的癌细胞的共同特征,反映了聚糖(如糖基转移酶和糖苷)生物合成的癌症特异性变化。在乳腺癌中,糖基化变化通常导致TACA的表达,这些抗原通常与细胞粘附、迁移、增殖和肿瘤生长有关。Han等人运用癌症选择性毒性的抗菌肽(ABPs)作为替代化疗药物治疗MX-1细胞,发现ABPs可通过增强与MX-1细胞表面存在O-、N-糖蛋白、神经节苷脂和唾液酸的结合活性,从而发挥显著的细胞毒性和凋亡活性,显示出高效的抗肿瘤作用[8]。
3. LHRH-R是一种G蛋白偶联受体,在配体结合后,主要依赖G蛋白进行下游信号传导。研究表明,G蛋白偶联受体(如 LHRH-R)和其他信号转导通路之间存在“串扰”,如配体诱导的LHRH-R激活可导致ErbB/HER受体家族的激活。Ana M等人表明运用AN-152(一种细胞毒性LHRH类似物)治疗MX-1肿瘤细胞时,发现MX-1肿瘤上LHRH-R水平显着降低,此外也显著降低了HER-3、HER-2的mRNA表达以及HER-3和HER-152蛋白的水平,显着抑制了小鼠中雌激素非依赖性、多霉素(DOX)耐药的MX-1肿瘤细胞的生长,提示LHRH-R引导的ErbB/HER受体家族的激活是又一条可有效控制乳腺肿瘤细胞生长的方式[9]。

图3.:MX-1乳腺癌干预靶点研究现状示例: 由Figdraw绘制。


* Asterisks indicate significant differences from controls at P < 0.001 (***), P < 0.01 (**), and P < 0.05 (*)
爱思益普肿瘤药理部利用MX-1模型,为人类乳腺癌提供精准的临床前药效研究服务。我们的专业平台支持各类分子体内药效研究,并通过阳药组测试验证抗肿瘤活性。爱思益普已为多家药企和科研单位提供稳定可靠的模型数据,推动了乳腺癌临床前研究,展现了在肿瘤药理研究领域的卓越实力和贡献。
[1]Reese JM, Suman VJ, Subramaniam M, Wu X, Negron V, Gingery A, Pitel KS, Shah SS, Cunliffe HE, McCullough AE, et al. ERβ1: Characterization, prognosis, and evaluation of treatment strategies in ERα-positive and -negative breast cancer. BMC Cancer. 2014;14:749.
[2]杜薇,谭婷婷,刘广庆,等.MX-1人乳腺癌细胞动物模型的建立[J].人人健康,2017,(10):8.
[3]Lai F, Liu Q, Liu X, Ji M, Xie P, Chen X. LXY6090 - a novel manassantin A derivative - limits breast cancer growth through hypoxia-inducible factor-1 inhibition. Onco Targets Ther. 2016 Jun 24;9:3829-40.
[4]Wang GL, Semenza GL. Purification and characterization of hypoxia-inducible factor 1. J Biol Chem. 1995;270(3):1230–1237.
[5]Wang GL, Jiang BH, Rue EA, Semenza GL. Hypoxia-inducible factor 1 is a basic-helix-loop-helix-PAS heterodimer regulated by cellular O2 tension. Proc Natl Acad Sci U S A. 1995;92(12):5510–5514.
[6]Chiche, J, Ricci, JE, Pouysségur, J. Tumor hypoxia and metabolism -- towards novel anticancer approaches. ANN ENDOCRINOL-PARIS. 2013; 74 (2): 111-4.
[7]Marxsen JH, Schmitt O, Metzen E, Jelkmann W, Hellwig-Bürgel T. Vascular endothelial growth factor gene expression in the human breast cancer cell line MX-1 is controlled by O2 availability in vitro and in vivo. Ann Anat. 2001;183(3):243-249.
[8]Han YY, Liu HY, Han DJ, Zong XC, Zhang SQ, Chen YQ. Role of glycosylation in the anticancer activity of antibacterial peptides against breast cancer cells. Biochem Pharmacol. 2013;86(9):1254-1262.
[9]Bajo, AM, Schally, AV, Halmos, G, et al.Targeted doxorubicin-containing luteinizing hormone-releasing hormone analogue AN-152 inhibits the growth of doxorubicin-resistant MX-1 human breast cancers.CLIN CANCER RES. 2003; 9 CLIN CANCER RES.
[10]Inoue K, Fujimoto S, Ogawa M. Antitumor efficacy of seventeen anticancer drugs in human breast cancer xenograft (MX-1) transplanted in nude mice. Cancer Chemother Pharmacol. 1983;10(3):182-6.
[11]Inoue K, Fujimoto S, Ogawa M. Comparison of antitumor activities of nitrosourea derivatives against mammary breast carcinoma (MX-1) in nude mice. Gan. 1980 Oct;71(5):686-91.
北京爱思益普生物科技股份有限公司 2010年创建,致力于打造靶点驱动的药物发现生物学平台。作为创新型CRO+的探索者,爱思益普专注于以“新靶点、新方法、新技术”解决创新药从靶点发现到候选化合物确认阶段的生物学和成药性的挑战;同时,爱思益普融合临床医学和生物学的专业团队,基于对疾病生物学及药物研发逻辑的深入理解,建立药物发现“一体化”的生物学平台为客户提供综合解决方案。爱思益普关注新药研发企业对质量、效率和成本的需求,用专业的生物学技术和高效的沟通帮助客户提高新药研发的效率及成功率。
爱思益普建立的技术平台包括:
1、基于靶点的药物筛选平台:建立了超过1500种药物靶点,涵盖大多数离子通道,GPCR,激酶和非激酶靶点以及近万个实验方法,建立了从生物物理学、生物化学、细胞生物学、电生理学平台以及各种多平台和高通量筛选技术。
2、体外和体内药效筛选评价平台:包括肿瘤、免疫、心血管、中枢神经系统、代谢基于细胞、组织或动物模型的药效学评价。
3、早期成药性筛选评价平台:包括药物发现阶段ADME和PK研究,以及药物脱靶效应筛选(hERG,safety panel,激酶谱等)
4、新分子平台:专注于ADC、多肽、蛋白降解、小核酸、细胞治疗等多种新分子的药物发现研究。












