
爱思益普,拥有人数100+、10年以上丰富经验的细胞生物学团队,可以提供包括小分子、PROTAC、ADC及抗体药物在内的各类药物的检测筛选服务,精于细胞生物学各种方法开发和探索实验,紧跟药物研发前沿动态,检测手段多样,合作方式灵活,可为工业及科研用户提供专业高效的筛选及检测服务。
靶向蛋白降解(Targeted protein degradation, TPD)是一种新兴的治疗方式,其通路大体分为泛素-蛋白酶体系统、内体-溶酶体系统以及自噬-溶酶体系统,TPD相对于传统小分子靶向治疗是极具潜力的药物发现及疾病治疗手段。
2001年,Deshaies与Crews首次提出泛素-蛋白酶体系统降解靶蛋白的蛋白水解靶向嵌合体(PROTAC)的概念,它们是由两个配体组成的异双功能小分子,一个配体招募并结合蛋白质(POI),另一个与E3泛素连接酶结合,从而形成“三体”聚合物,诱导POI的泛素化,随后被泛素-蛋白酶体系统(UPS)降解,PROTAC还可被循环利用,靶向POI的其他拷贝(图1)。2008年,Crews教授团队设计出基于E3连接酶MDM2的首个小分子PROTAC,可用于降解雄激素受体(AR),这一发现是该领域发展的一个重要里程碑,从那以后,科学家们相继研发出大量可降解不同靶蛋白的PROTAC分子,2019年,PROTAC分子ARV-110和ARV-471首次进入Ⅰ期临床实验,2020年,针对两种既定癌症靶点(雌激素受体ER和AR)的PROTAC分子被首次验证成功(图2),使得TPD领域更加壮大,逐渐从学术界走向工业界,许多公司已在探索PROTAC临床前和早期临床开发计划。

图1. PROTAC的分子机制
迄今为止,传统的针对细胞内靶点的小分子药物发现研究通常集中在开发高亲和力抑制剂上,这些抑制剂要么靶向酶的活性位点,要么靶向酶的变抗位点,以关闭POI的功能,尽管方法有效,但难以发现其他潜在的药物靶点。相比于传统小分子,PROTAC具有多种优势,例如:传统小分子需要知晓靶蛋白的内在作用位点和机制,而 PROTAC 则不用重视靶蛋白本身机制,无需竞争性位点,只要结合上,直接将靶蛋白泛素化标记后降解即可,此外,PROTAC仅需少量就可发挥药效,用量常常是纳摩尔级别,解决了许多肿瘤相关的胞内蛋白与核蛋白的不可成药问题。
由于PROTAC作用机制特殊,竞争机制不够成熟,配体的结合强度、空间取向、细胞通透性等因素将对其功效产生重要影响,因此,这些因素如何协同工作以实现最高效率是一个需要解决的重大科学问题,在安全性和活性评价方面需也要多加注意,相信一旦解决上述问题,将为PROTAC技术的发展和抗肿瘤新药的研发开辟一条广阔的道路。

图2 TPD发展里程碑
爱思益普(ICE Biosci)成立于2010年,服务范围广泛,涵盖了临床前药物发现和靶点验证以及临床前生物学评价,主要技术平台包括靶点验证和构建、靶点库和药物筛选、成药性评价ADMET平台、 肿瘤和免疫药物发现平台、中枢神经系统药物发现平台以及心血管系统药物发现平台。
在靶向蛋白降解方面,ICE具有“从头”的能力,具备多种蛋白表达系统(包括昆虫、哺乳动物、细菌等),可以定制化的生产和纯化蛋白,为PROTAC分子的体外测试提供高纯度蛋白。此外,分子互作、酶学、细胞编辑及胞内降解、动物模型等平台的强有力支撑也对PROTAC分子的筛选起到加速作用。
PROTAC已成为目前备受关注的领域,ICE所具备的技术可以支撑PROTAC领域的全方面检测评价,从TPD验证到E3配体选择与优化,以及细胞外降解测定与机制研究(图3)。在靶向蛋白降解检测方面,ICE具有丰富的技术储备,从传统的WB到数字化WB(JESS),以及In-cell WB(ICW)和IFA,可对目前新药研发领域的热门靶点进行降解检测。本文重点介绍JESS在PROTAC平台中发挥的作用。

图3 ICE-PROTAC平台
WB作为经典的生物学验证方法在市场上已被广泛应用,如何实现WB数据规范化管理和数据长久保存,以便随时提取数据成为科研界急需解决的问题,ICE具备成熟的JESS检测技术,已实现多个项目靶点的检测与优化,涉及心血管系统、神经系统、肿瘤以及炎症等多种疾病领域。

图4 JESS全自动蛋白质表达定量分析系统
相比传统WB,JESS具备多种独特优势,首先,JESS对样品的需求量较低,可以节约样品用量;JESS所有实验均为全膜WB,对抗体原液消耗较少,可大幅降低抗体成本消耗;JESS检测速度快,可以实现更早的项目交付;除此之外,JESS全程自动化标准化,对于样品的定量更为准确,更好的避免人为失误;最重要的是,JESS实现了数据可重复和数据永久保存,且图像质量较高,在任何时候,都可以随时提取数据。截至目前,ICE团队已利用JESS平台完成近百个靶点蛋白的优化、可直接针对客户需求开展相关测试。
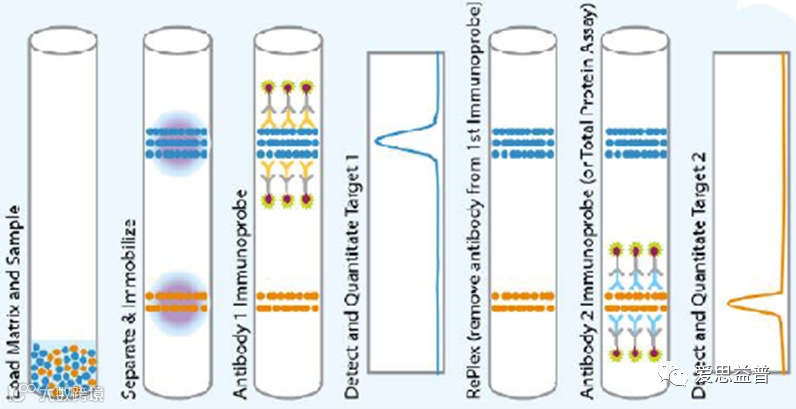
图5 JESS运行示意图
布鲁顿酪氨酸激酶(BTK)是胞浆内非受体型酪氨酸激酶TEC家族中的一员,它在B细胞的增殖、分化和死亡中发挥作用,在血液系统恶性肿瘤中表达,因此,它被认为是治疗血液系统恶性肿瘤的关键靶点。BTK不仅可以作为激酶,还可以以激酶非依赖性的方式增强抗原受体诱导的钙内流,BTK降解可作为解决BTK抑制耐药性的策略,因此,开发BTK降解剂以消除激酶依赖性和独立性功能引起了学术界和工业界的极大兴趣。
目前,已有研究者构建新型高溶解度BTK蛋白降解剂PROTAC,并克服了BTK蛋白突变引起的B细胞淋巴瘤(BCL)对临床一线药物伊布替尼的临床耐药性,在体内实验中也得到了验证。例如,在PROTAC应用上,CRBN蛋白通过BTK蛋白裂解物被招募到C481S突变的BTK蛋白上,致使蛋白被泛素化,最终使BTK被蛋白酶体识别和降解(图6)。接下来,以BTK靶点为例,介绍ICE利用JESS技术在PROTAC中得到的数据成果。

图6 PROTAC分子对BTK的降解[5]
ICE分子生物学团队利用JESS技术准确检测出化合物对于BTK的降解:

图7 JESS检测BTK降解的数据展示
针对PROTAC领域的热门靶点,如WRN、SOS1、KRAS、PKMYT1、EGFR、AR、cMyc、SMARCA2/4、IRAK1/4、GSPT1、PARP1/2、CDK2等靶点,ICE已经优化、建立好相关的JESS实验条件,可检测的靶点也在持续增加中。

图8 JESS检测WRN、EGFR、SOS1和BTK的数据展示
PROTAC领域在快速蓬勃发展的同时,也存在诸多挑战亟待解决(图9),首先,目前报道的部分PROTAC可能同时或单独通过分子胶原理引起靶蛋白降解,而如何区分这两者并加以融合应用是未来的研究挑战之一;目前针对PROTAC分子,尚无成熟的PK和PD评价体系,传统方法无法准确评估PROTAC的PK和PD性质;如何理性设计PROTAC,快速有效筛选目标蛋白配体,更深入的理解降解活性,选择性及可能的脱靶效应是关键问题;此外,目前针对非成药靶点降解剂报道较少,因此未来还需要更多的案例来佐证PROTAC在非成药靶点方面的优势,拓展可用于PROTAC技术的E3泛素连接酶也是ICE所面临的PROTAC平台挑战之一。相信ICE会与广大同仁共同努力,这些问题在不远的将来都可以得到解决。

图9 PROTAC面临的挑战
在未来的PROTAC科研平台中,ICE会寻找更加多样化的E3连接酶以及分子量小、活性高的E3配体,拓宽靶点和适应症的应用范围,结合抗体偶联、纳米载药等递送策略提高成药性和安全性,拥抱具有预测功能的新型计算工具,致力于开发新靶点和配体,发现新药。此外,ICE会更好的应用JESS技术协助PROTAC平台实验研究,有效发挥JESS检测优势,实现高质量数据交付。
结束语:
爱思益普团队走在新药研发领域的前沿,深入研究药物作用机理,时刻关注新药靶点最新动向,公司非常重视产学研结合,以优质化服务和科技创新为根本,不断优化实验策略,开发优质高效的产品,公司以营销创新、合作共赢、稳健发展为合作理念,发挥我司产品在市场上与客户的双赢利益,竭诚为国内外客户提供研发和检测服务,给予客户以长远稳定的回报,为中国蛋白降解领域的药物研发做出一些贡献。
对PROTAC相关服务以及JESS检测技术感兴趣的同仁,可以随时与我们联系,爱思益普真诚欢迎大家的到来!
撰稿人----周梅洁
[1] Qi SM, Dong J, Xu ZY, et al. PROTAC: An Effective Targeted Protein Degradation Strategy for Cancer Therapy. Front Pharmacol. 2021 May, 12: 692574.
[2] Békés M, Langley DR, Crews CM. PROTAC targeted protein degraders: the past is prologue. Nat Rev Drug Discov, 2022 Mar, 21(3): 181-200.
[3] Hu Z, Crews CM. Recent Developments in PROTAC-Mediated Protein Degradation: From Bench to Clinic. Chembiochem, 2022 Jan 19, 23(2): e202100270.
[4] Yao T, Xiao H, Wang H, et al. Recent Advances in PROTACs for Drug Targeted Protein Research. Int J Mol Sci, 2022 Sep 7, 23(18): 10328.
[5] Ma K, Han XX, Yang XM, et al. Proteolysis targeting chimera technology: a novel strategy for treating diseases of the central nervous system. Neural Regen Res, 2021 Oct, 16(10): 1944-1949.
[6] Yang J, Li Y, Aguilar A, et al. Simple Structural Modifications Converting a Bona fide MDM2 PROTAC Degrader into a Molecular Glue Molecule: A Cautionary Tale in the Design of PROTAC Degraders. J Med Chem, 2019 Nov 14, 62(21): 9471-9487.
[7] Wang,S. M. Targeting the undruggable: PROTAC approach to target transcriptionalfactors. Abstr Pap Am Chem S, 2019: 257.
公司介绍
截至目前,爱思益普为600家以上的国内新药研发机构提供服务,得到客户广泛好评;每年有数百个项目进行新药临床研究(IND)申报,多个项目通过NMPA的现场核查。



