
点击箭头处“蓝色字”,关注我们哦!!
国家食品药品监督管理总局于2015年5月27日发布了《国家食品药品监督管理总局关于发布药品、医疗器械产品注册收费标准的公告(2015年第53号)》,公布了《药品、医疗器械产品注册收费标准》、《药品注册收费实施细则(试行)》和《医疗器械产品注册收费实施细则(试行)》,调整了药品注册收费标准,制定了医疗器械新的收费标准。
医疗器械注册收费,是国际通行的一项既有成熟制度。国际上美国、欧盟等国家和地区都对医疗器械的注册活动进行收费。实践证明,这是一项促进行业健康发展的有效途径。
我国实施医疗器械注册收费政策,在一定程度上加大了企业的注册成本,但不会构成较大的负面影响。企业是典型的“理性经济人”,注册成本增加会刺激企业强化质量,从而获取质量提升带来的经济回报。从长远看,有利于提升企业对医疗器械产品的注册质量管理水平,也有利于国家进一步规范管理医疗器械注册工作。
那么,截止至2018年11月16日,我国已有24个省/市/自治区公布二类收费标准,其中,九个省市相继降低二类医疗器械注册收费标准,吉林省注册收费下调5%,陕西省变更及延续注册费用分别降低10%,黑龙江省国产二类医疗器械首次、变更及延续注册费用各减少20%,具体情况弗锐达小编为大家整理如下:
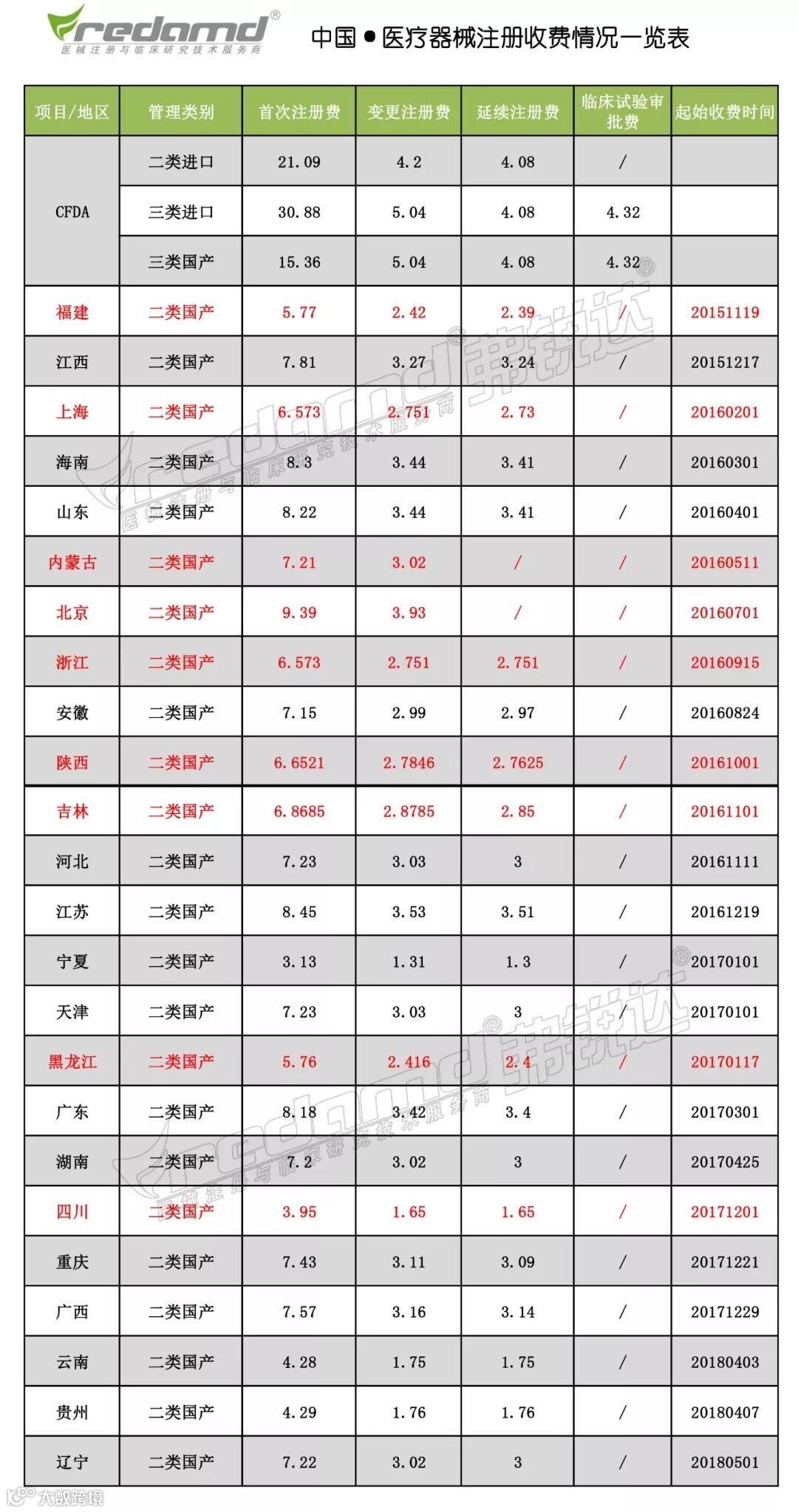
由上图可见,北京虽然免收延续注册费用,
但其首次注册费用依然处于领跑地位,
与最低的宁夏回族自治区相比,差值约6.2万元
海南、山东、江苏、广东首次注册费用都超过8万元
而四川、云南、贵州首次注册收费标准较低,不超过5万。

福 建 省
福建省物价局福建省财政厅发布《关于降低药品及医疗器械产品注册费收费标准的通知》(闽价费〔2018〕187号),规定于2018年9月20日起,首次、变更及延续注册费用各减少30%。

上 海 市
上海市食品药品监督管理局发布《关于调整药品医疗器械产品注册收费标准的公告》(2018年第79号),对国产二类医疗器械注册收费做了调整。首次、变更及延续注册费用各减少30%,此规定自2018年10月1日执行。

内 蒙 古 自 治 区
内蒙古自治区财政厅发布《发展和改革委员会关于取消和免征一批行政事业性收费的通知》(内财非税〔2017〕472号),规定自4月17日,免收延续注册费。

北 京 市

北京市财政局发布《北京市发展和改革委员会关于清理规范一批行政事业性收费有关政策的通知》(京财综〔2017〕569号),规定自2017年4月1日,免收延续注册费。

浙 江 省
浙江省人民政府发布《浙江省人民政府办公厅关于进一步减轻企业负担增强企业竞争力的若干意见》(浙政办发〔2018〕99号),规定于2018年8月1日,浙江省注册费用下调30%。

陕 西 省
陕西省物价局、陕西省财政厅发布《关于核定药品及医疗器械产品注册收费标准的复函》(陕价费函〔2018〕102号),规定自2018年7月21日,国产二类医疗器械首次,变更及延续注册费用分别降低10%。


吉 林 省
吉林省物价局发布《吉林省财政厅关于降低部分涉企行政事业性收费标准的通知》(吉省价收〔2017〕133号),规定自2017年8月1日起,吉林省注册收费下调5%。

黑 龙 江 省
黑龙江人民政府发布《关于清理规范一批涉企收费项目的通知》(黑政办规〔2017〕33号),规定自2017年8月1日,黑龙江省国产二类医疗器械首次、变更及延续注册费用各减少20%。


四 川 省
四川省发展和改革委员会发布《关于调整我省药品、医疗器械产品注册收费标准的通知》(川发改价格〔2017〕584号),规定自2017年12月1日至2019年12月1日按50%征收注册费。

注 册 收 费 演 变 ▼

[ 开天辟地——鉴定费!]
1992年10月16日,国家物价局、财政部联合发布《关于发布中央管理的医药系统行政事业性收费项目及标准的通知》([1992]价费字534号)规定:
申请鉴定第一类医疗器械新产品的单位应向国家医药管理部门医疗器械新产品审查办公室交纳鉴定费,每个产品3,000元;
申请鉴定第二类、第三类 医疗器械新产品的单位向省级医药管理部门医疗器械新产品审查办公室或相应机构交纳鉴定费,具体收费标准由省级物价部门会同财政部门制定, 最高不得超过2,000元。
[ 步入正轨——“鉴定费”更名为“注册费”]
2000年10月3日,国家计委发布《关于变更医疗器械产品审查收费项目名称的复函》(财综字[2000]15号)中规定:
根据《医疗器械监督管理条例》的有关规定,同意将原医疗器械新产品鉴定费的名称变更为医疗器械产品注册费。
省级以上药品监督管理部门收取医疗器械产品注册费,暂按《国家物价局、财政部关于发布中央管理的医药系统行政事业性收费项目及标准的通知》(价费字[1992]534号)中有关原医疗器械新产品鉴定费的规定执行,不得擅自扩大收费范围或提高收费标准。
[ 幸福来得突然——停收注册费 ]
2008年11月13日,财政部、国家发改委联合发布《关于公布取消和停止征收100项行政事业性收费项目的通知》(财综[2008]78号)宣布:
自2009年1月1日起,国家食品药品监督管理部门取消医疗器械产品注册费、化妆品审批费、新资源食品(保健品)申请审评费。
[ 再上征途——首次、变更及延续均收费 ]
2015年4月21日,财政部、国家发改委联合发布《关于重新发布中央管理的食品药品监督管理部门行政事业性收费项目的通知》(财税[2015]2号)明确5项医疗器械产品注册收费事项:
首次注册费;
变更注册费;
延续注册费;
临床试验申请费;
医疗器械产品注册加急费。
补充:
1、首次注册费。
(1)境内第三类医疗器械产品和进口第二类、第三类医疗器械产品向国家食品药品监督管理总局申请注册时支付;(2)境内第二类医疗器械产品向省级食品药品监督管理部门申请注册时支付。
2、变更注册费。
(1)境内第三类医疗器械产品和进口第二类、第三类医疗器械产品向国家食品药品监督管理总局申请变更注册时支付;(2)境内第二类医疗器械产品向省级食品药品监督管理部门申请变更注册时支付。
3、延续注册费。
(1)境内第三类医疗器械产品和进口第二类、第三类医疗器械产品向国家食品药品监督管理总局申请延续注册时支付;(2)境内第二类医疗器械产品向省级食品药品监督管理部门申请延续注册时支付。
【来源】弗锐达医械资讯
【声明】文章内容与信息来源于互联网或转载,不代表本订阅号赞同其观点。如转载内容涉及版权等问题,请立即与我们联系,我们将迅速采取适当措施。
文章转载于:医疗器械创新网
 程天科技
程天科技
致力于外骨骼机器人技术、智能医疗、特种机器人技术与其周边应用软件数据平台开发等领域。
 0571-89167832
0571-89167832
 sales@roboct.com
sales@roboct.com
 http://www.roboct.com
http://www.roboct.com

关注程天科技获得更多内容!


