
点击蓝字 关注我们

题目:基因编辑技术的过去、现在和未来
期刊:Cell IF:64.5/Q1
单位:苏黎世大学生物化学系
发表时间:2024年2月
基因编辑已经成为生命科学和人类医学领域的一项革命性技术,为解剖复杂的生物过程并治疗许多遗传疾病提供了前所未有的机会。CRISPR技术以其卓越的效率和易编程性,成为这场变革的先锋。本文综述了CRISPR基因编辑技术在研究和治疗领域的现状,强调了其受限制的因素以及近年来针对这些限制因素的技术创新。此外,本文还概述了基因编辑在人类健康和治疗中的应用现状,并展望了未来几年基因编辑技术及其应用的潜在发展方向。

基因编辑的过去

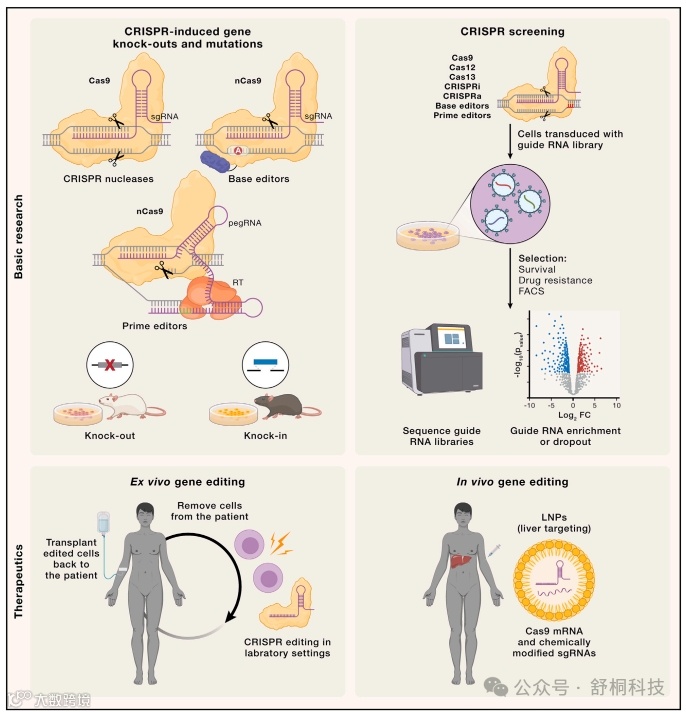
基因编辑技术的发展可以追溯到20世纪90年代初期。最初的研究使用靶向内切酶(如I-SceI),在哺乳动物细胞中诱导靶向双链断裂(DSB),从而刺激靶位点的同源重组。这为利用DSB产生的核酸酶进行基因组编辑奠定了基础。随后,人们意识到需要多样性的长识别位点核酸酶,以便在真核基因组中定位到单个位点。为了满足这一需求,出现了工程核酸酶,如锌指核酸酶(ZFNs)和转录激活样效应子核酸酶(TALENs)。然而,它们的设计和生成过程繁琐,限制了它们的应用。
2007年研究表明,原核CRISPR-Cas系统能够识别和靶向外源核酸,这标志着基因编辑技术进入了新时代。CRISPR-Cas系统的发现引发了基因编辑技术的革命,因为它们具有简单的编程性、高度特异性和多功能性。2012年,科学家们研究发现Cas9作为一种DNA内切酶,其特异性由双RNA引导结构决定。随后,通过将两个RNA组分整合为单个导RNA(sgRNA),CRISPR-Cas9系统的设计进一步简化,为基因组编辑技术的快速发展铺平了道路。自此以后,CRISPR-Cas9系统成为主导的基因编辑工具,广泛应用于各种生物学研究和生物技术领域。不断的技术改进和创新将进一步推动基因编辑技术的发展,为生命科学和医学领域带来更多的突破和进步。

CRISPR基因组编辑的限制
CRISPR-Cas系统作为简单有效的可编程基因编辑工具的重新应用,极大地推进了许多基础和应用研究,为开发靶向基因治疗和各种生物技术应用奠定了基础。然而,高度进化的生物防御系统功能特征与精确的基因组编辑工具的功能有所不同。因此,第一代基于CRISPR的基因编辑工具的应用潜力受到几个关键因素的限制,尤其是特异性和脱靶效应。

(1)脱靶效应
自然的CRISPR-Cas系统在一定程度上容忍引导RNA和目标之间的错配,这可能是为了对抗噬菌体高突变率的进化结果。然而,这种特性对于基因组工程应用来说是不受欢迎的,因为它可能导致除了预期的目标位点之外,基因组中其他部分互补性较低的非目标位点也被靶向和编辑。脱靶的范围可以从含有单个碱基错配的位点到含有多个连续错配的靶标,甚至核苷酸插入或缺失。
(2)靶向范围:PAM要求
CRISPR核酸酶的DNA结合机制将其靶向范围限制在由PAM序列所覆盖的基因组目标位点上。尽管最广泛使用的基因组编辑核酸酶SpCas9的NGG PAM理论上平均每8个核苷酸就允许找到一个合适的目标位点,但由于高A/T含量,某些基因组区域并不容易成为SpCas9的靶点。另外,Cas12a核酸酶识别富含T的PAM序列,典型为TTTV,但其靶向范围同样受限。
(3)编辑结果的控制
HDR的使用仅限于分裂细胞,并且由于末端连接途径导致的同时编辑,常常会产生异质等位基因的编辑结果。此外,预期基因组目标位点的编辑精度受到其他不利结果的限制,包括大片段缺失、染色体重排,甚至染色体丢失。因此,大量研究致力于开发控制DNA修复结果的方法,特别是刺激HDR修复的速率,从而提高插入突变的效率。
(4)递送
基因编辑器的靶向递送仍然是大多数体内和体外基因编辑应用的限制因素。特别是,将CRISPR组分安全、特定且高效地递送到目标细胞是成功治疗性基因组编辑的先决条件。此外,CRISPR组分及其递送载体的免疫原性对体内治疗应用提出了关注。

现在:基因编辑技术与应用

近年来,基于Cas9和Cas12a核酸酶的第一代依赖于DSB(双链断裂)的基因组编辑器的能力已经通过持续的创新得到增强,这些创新不仅增加了这些工具的多功能性,还提高了它们的精确度并最小化了非预期编辑的后果。然而,由于非目标编辑活动和目标DSBs潜在的遗传毒性效应(包括p53的诱导),对其安全性的担忧仍然存在。为了减少非预期编辑的发生,已经探索了许多方法来精确控制CRISPR基因组编辑器的时空表达。对DSBs的遗传毒性和需要解决HDR(同源定向修复)低效率的担忧进一步促进了“第二代”CRISPR技术的发展,这些技术在不依赖于DBS形成和HDR的情况下进行基因组编辑。

(1)Cas9以外的核酸酶
2015年Cas12a的发现标志着超越Cas9的重要扩展,提供了一种具有不同PAM要求、引导RNA格式和DNA切割模式的替代核酸酶。报道,Cas12a酶在体内表现出更高的特异性和更低的非目标活性。此外,像Cas13、Cas12a2和Cas12g这样的RNA靶向RNA引导核酸酶为分子编辑工具箱引入了新的模式,允许靶向降解或编辑mRNA,以及核酸检测。尽管这些发现带来了新的能力,但每种Cas核酸酶都带有自己的一套限制,包括受限的PAM靶向、体内活性的变异性和非目标剖面,或潜在的免疫原性。
(2)高保真Cas9变体
为了解决非目标活性的问题,通过两种互补的方法开发了具有提高特异性的SpCas9工程变体。第一种方法涉及基于结构的合理设计,以增强保真度的突变,第二种方法利用定向进化方法选择减少非目标编辑的突变。尽管迄今为止开发的高保真变体比野生型酶提供了显著增加的特异性,但它们的效率可能因不同的DNA目标和应用而变化。
(3)向导RNA修饰
通过工程化基因组编辑器的引导RNA来提高特异性,提供了一个引人注目的替代方案,避免了使用高保真核酸酶突变体。
(4)其他的PAM基因编辑器
为了克服Cas核酸酶依赖PAM的目标位点限制,一些研究通过基于结构的合理工程设计或定向进化来引入改变特异性的氨基酸替换,以扩展SpCas9的PAM靶向范围。最近已经开发出能够针对NRN PAM的SpCas9变体,包括几乎“无PAM”的Cas9设计。
(5)碱基编辑器(BE)
这种方法通过融合Cas9核酸酶变体(nCas9)和核苷酸修饰酶,使单个核苷酸直接转化为另一种,无需产生双链断裂。此方法特别适用于引入特定的点突变(例如A到G或C到T,也可以是A到C或C到G),从而实现精确的基因校正或引入终止密码子以实现精确的基因敲除。
(6)先导编辑器(PE)
该技术结合了Cas9核酸酶和反转录酶(RT),并使用由Cas9 sgRNA与RT模板(RTT)和引物结合位点(PBS)融合而成的先导编辑引导RNA(pegRNA)。切割非目标DNA链后,RT可以扩展其序列,从而将RTT序列复制到目标位点上。先导编辑能够实现插入、删除和替换短DNA序列,长度可达数十个核苷酸。
(7)转录调节:CRISPRi和CRISPRa
为了在真核细胞中抑制基因表达,可以将核酸酶失活的Cas9与各种转录和表观遗传调节因子融合,例如KRAB转录抑制子结构域,并定位到活跃转录基因的启动子区域。由此产生的方法,称为CRISPR干扰(CRISPRi),能够高效地敲低基因表达,作为基于小干扰RNA(siRNA)的RNA干扰的替代方法。CRISPR激活(CRISPRa)通过将dCas9与转录激活结构域(如VP64及其衍生物)融合而实现。另外,与组蛋白修饰酶(如去甲基化酶或乙酰化酶)的融合可以特异性地改变特定位点的表观遗传标记,并诱导活跃的染色质状态以驱动基因表达。这些方法已被广泛适应于全基因组功能丧失(CRISPRi)或功能增强(CRISPRa)筛选。
(8)靶向RNA沉默和修饰
与基因编辑不同,RNA编辑利用RNA靶向的Cas13核酸酶,在催化活性下用于靶向转录降解,或在催化失活后与腺苷脱氨酶融合,用于转录编辑。
基因编辑目前在基础研究和人类医学中的应用
随着CRISPR-Cas9技术的不断成熟,其在基因治疗领域的应用逐步展现。通过精确修改或修复病理性基因,CRISPR-Cas9为遗传性疾病的治疗提供了新的可能。
01
逆向遗传学
CRISPR基因组编辑对于产生同基因型细胞疾病模型起到了重要作用,使研究人员能够在野生型细胞中引入特定突变,或者反过来,将患者来源的细胞中的突变恢复为野生型,以产生对照细胞系。此外,CRISPR基因组编辑在研究疾病表型、患者来源的细胞、类器官或模型生物中的使用也越加广泛。通过编辑人类诱导多能干细胞(iPSCs)并引导它们分化成受疾病影响的特定细胞类型,研究人员可以在相关的细胞环境中研究疾病。CRISPR工程化类器官能够模拟受疾病影响器官的复杂性,已经被用于通过在肿瘤抑制基因或癌基因中引入突变来模拟癌症。CRISPR工程化的模型生物,包括秀丽隐杆线虫和斑马鱼,也有助于建立特定突变与人类遗传疾病之间的联系。这些模型在复制罕见的人类发育障碍方面特别成功。啮齿动物,主要是小鼠,是使用CRISPR编辑促进产生多重或条件性基因敲除或敲入的最常用的动物疾病模型。更大的动物模型,包括非人灵长类、猪和狗,表现出与人类更大的生理和遗传相似性,常用于研究衰老和慢性疾病的进展。人类心血管疾病已成功地在CRISPR编辑的猪或狗中模拟。
02
正向遗传学
全基因组敲除筛选是研究疾病的有力工具。CRISPR筛选能够系统地干扰细胞内数千个单个基因和非编码基因组元件,促进与特定生物途径及其相互作用相关的基因的鉴定。此外,在斑马鱼胚胎中也进行了体内聚合CRISPR筛选,使单个基因失活并分离具有目标表型的胚胎,以确定相关的遗传改变。除了全基因组筛选之外,CRISPR基因组编辑工具还促进了细胞谱系追踪方法的发展,以监控细胞增殖并重建细胞谱系树。在细菌中,基于含有RT的CRISPR间隔获取机制的转录记录能够直接、按时间顺序捕获基因组中转录RNA的序列。这项技术的应用已经扩展到对小鼠肠道微生物组的体内研究。
03
体内外治疗应用
基于CRISPR的基因组编辑技术对患者来源的细胞进行体外编辑,随后进行扩增和重新移植,是治疗表现在血细胞中的遗传性疾病的强大策略。如,针对β-地中海贫血和镰状细胞贫血等血液疾病的基因治疗已进入临床试验阶段。此外,非常热门的嵌合抗原受体(CAR) T细胞疗法涉及体外工程化T细胞以针对癌症细胞标记物也在快速发展中。未来基因疗法的一个潜在强大策略是将体外CRISPR基因组编辑与iPSC技术相结合。最近开发的一种用于管理1型糖尿病的方法涉及基因组工程iPSCs,将它们分化为胰腺内胚层细胞,并将其封装在生物相容性设备中,以植入患者体内,以实现胰岛素生产,这对于管理1型糖尿病至关重要。
与体外策略相反,体内治疗性基因编辑涉及通过局部或全身递送直接向体内受影响组织使用CRISPR基因组编辑器。已经有多个原理验证的临床前研究成功地展示了体内治疗性基因编辑,尤其是在杜氏肌营养不良症动物模型中通过肌肉定向递送Cas9和引导RNA使用AAV9载体恢复营养不良蛋白表达的努力,以及通过AAV9介导的CBE递送到大脑来挽救小鼠脊髓肌萎缩症模型的疾病。

基因编辑的未来

展望未来,基因编辑技术的研究重点包括开发更具特异性、免疫原性更低的递送载体,减少脱靶效应,加强编辑结果的控制,提高基因组编辑的准确性和精确度。
与纯粹基于蛋白质的技术相比,核酸引导系统由于其简单的可编程性和适应性,可能仍将是基因组编辑的核心。然而,它们的应用模式可能会发生变化,可能会转向更瞬时的编辑方法,以最大限度地降低意外的长期遗传变化或瞬时递送的风险,以最大限度地减少基因组破坏和免疫反应。

由于第一代技术已被批准用于临床,通过体外编辑治疗镰状细胞病(SCD)和β-地中海贫血等疾病,体内方法也不甘落后,限制未来针对多种疾病的基因组定向疗法开发的瓶颈将不再是缺乏安全、高效或精确的基因组编辑器。主要的挑战将在于递送方法,特别是对于血液和肝脏以外的器官及某些细胞类型的体外递送。随着新的递送载体的开发以及致病变异及其纠正策略的表征,可能会极大促进CRISPR技术的应用。
在此背景下,基于人工智能方法的兴起将使我们能够准确地模拟复杂的基因组编辑环境,预测靶向和脱靶编辑结果,并设计出更有能力的基因组编辑器,从而加快实施安全治疗方法的步伐。然而,伦理和社会影响,特别是有关人类种系基因组修改的伦理和社会影响,仍将是基因组编辑讨论的重点。
总之,尽管存在挑战,CRISPR基因组编辑技术的未来依然是光明的。它不仅有可能推动研究突破,彻底改变人类医学,而且有可能促进农业发展,应对生态挑战,从而为人类创造更健康、更可持续的未来奠定基础。
珠海舒桐医疗科技有限公司是一家以基因编辑为核心技术的生物医药企业,公司搭建了一站式基因编辑平台,可提供从靶点筛选、基因编辑有效性检测到安全性评估的全流程解决方案。公司熟练掌握各类基因编辑技术,包括基因编辑、碱基编辑及先导编辑等,成功完成如基因敲除、点突变、大片段插入、过表达等细胞系构建项目;开发了多种具有自主知识产权的脱靶检测技术,建立了高通量的sgRNA筛选平台;建立了工厂化新型CRISPR挖掘体系,已开发出多种切割效率高且低脱靶的新型CRISPR。

如需获得更多信息,请咨询我们:
电话:
400-6309596
15022705442(同微信)
企业官网:
http://www.generulor.com
产品订购/技术支持:
service@generulor.com


