这一期,我们来了解下护目镜和防护服如何出口!
1.商品归类
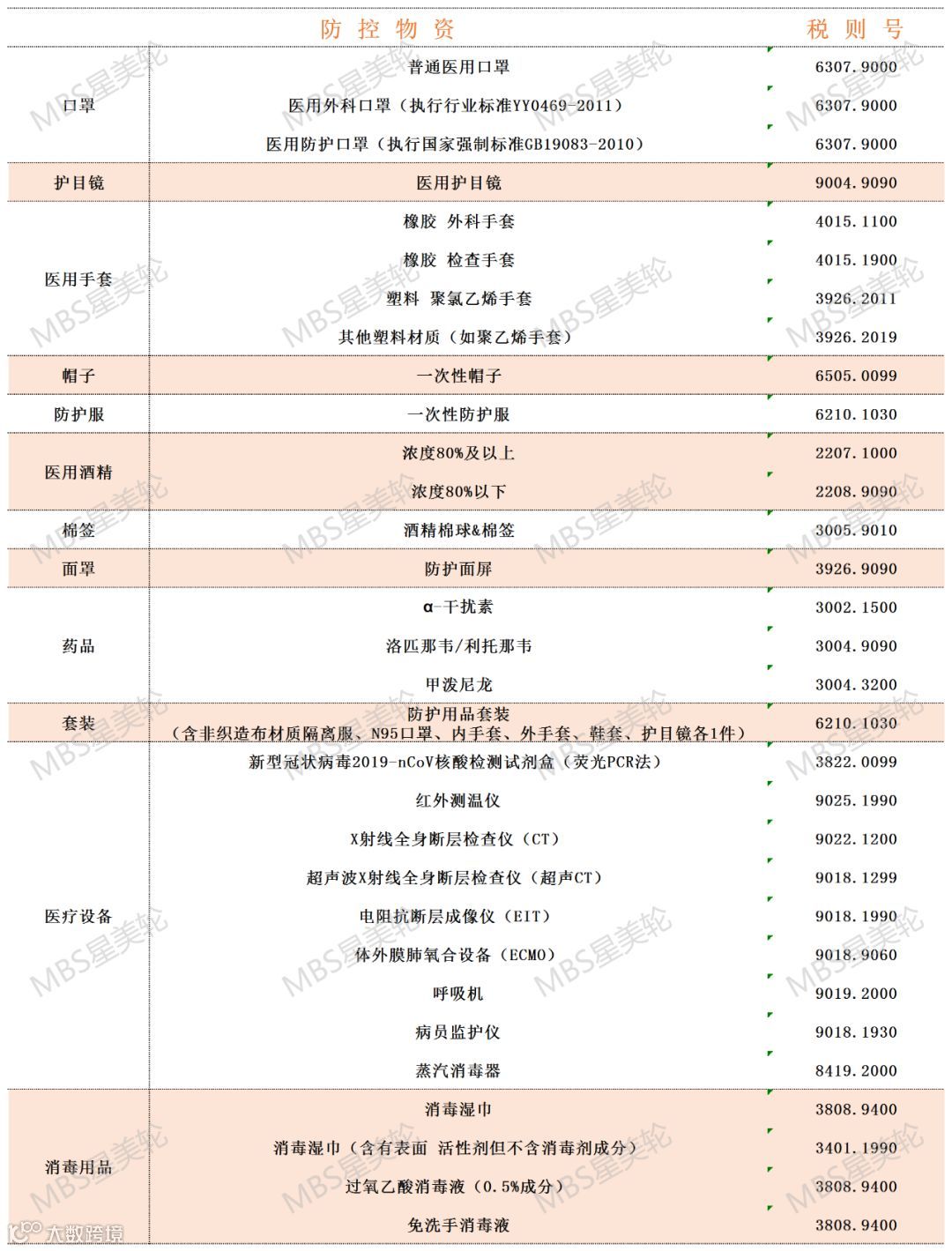
2.禁限管理:
目前商务部未对防护手套、护目镜设置贸易管制要求,中国海关也无针对手套、护目镜物资的监管证件口岸验核要求。
防护手套按照材质不同可分为丁腈手套、PVC手套、乳胶手套和PE手套,根据品质等级和用途可分为医疗级和非医疗级,医疗级手套是指需要满足目标国家医疗市场质量认证体系或准入标准的产品,主要用于医疗手术、医疗检查、医疗护理等领域。


护目镜防止一些飞沫或血液等飞溅到脸部,因而对眼睛起保护作用,一般和口罩、手术帽配合使用,对头部起到全面防护作用。

1.美国
必须要取得美国食品和药物管理局FDA注册认证才可以在美国本土市场进行销售。
一次性医用手套,包括用于处理化学治疗剂(化疗手套)的检查手套,手术手套和医用手套。这些手套由FDA监管为医疗器械,需要按照美国《联邦食品、药品和化妆品法》510(k)条款的要求执行上市前通告(Premarket Notification),向FDA申请产品上市许可。FDA审查这些设备,以确保满足诸如防漏性,抗撕裂性和生物相容性等性能标准。
提示注意:2016年12月19日,美国食品和药物管理局发布了一项禁止粉末手套的最终规则,决定在医疗活动中禁用有粉手套,包括有粉外科手套、检查手套和用于润滑可吸收粉未的外科手套。
护目镜通常注册Ⅰ类医疗器械,绝大部分产品是510K豁免的,实行的是一般控制(General Control),企业只需要进行企业注册(Registration)和产品列名(Listing),和实施GMP规范QSR820(其中一部分产品连GMP也豁免),产品即可进入美国市场。
须获得欧盟CE认证,并符合技术法规:(EU)2016/425
手套、护目镜与防护服同属个人防护装备(PPE),在欧盟同受(EU)2016/425技术法规管辖,需要强调的是欧盟法规(EU) 2016/425,于2018年4月21日正式实施,撤销并替代了PPE指令89/686/EEC,并指出2019年4月21日之后投放市场的产品必须满足(EU)2016/425中所有的要求,此期限,出口外贸企业和生产企业须重点注意。
欧盟个人防护装备法规(EU)2016/425协调标准查询:
https://ec.europa.eu/growth/single-market/european-standards/harmonised-standards/personal-protective-equipment_en
3.日本
如果需要投放市场产品必须满足日本的Pharmaceutical and Medical Device Act (PMD Act),在PMD Act的要求下,TOROKU注册系统要求国外的制造商必须向PMDA注册制造商信息。
日本医药品和医疗器械综合机构(PMDA)网址:www.pmda.go.jp
4.韩国
韩国医疗器械准入的法规门槛,基本分类为I、II、III、IV类,持证为韩国公司(License holder),韩国收货人需要到韩国药监局Korea Pharmaceutical Traders Association. 提前备案进口资质(没有不行)网址:www.kpta.or.kr。
目前韩国食品药品安全部正在进行快速许可,许可审查部门的联系方式如下:(联系以获取进口业务报关单和产品授权书,并迅速处理进口要求。)部门 联络方式 :
《医药辅品的批准、通知、评价法规》可在https://www.mfds.go.kr/eng/brd/m_27/view.do?seq=70665&srchFr=&srchTo=&srchWord=&srchTp=&itm_seq_1=0&itm_seq_2=0&multi_itm_seq=0&company_cd=&company_nm=&page=4下载。
5.澳大利亚
须通过澳洲的TGA注册,TGA 是Therapeutic Goods Administration的简写,全称是治疗商品管理局。澳大利亚对医疗器械分为I类,Is and Im, IIa, IIb, III类,分别为豁免、备案和注册。无论哪类医疗器械,其上市销售前必须得到澳大利亚政府的准许,符合医疗器械的基本要求,按照符合性审查程序进行审查。
医用手套、护目镜一般归为中低风险和低风险的医疗器械,对于低风险的医疗器械由企业自行进行评估,只要符合质量和安全条件即可进入市场,但要提供相关文件证明其安全有效,并进入医疗用品注册系统,进行编号管理。大多数的器械按备案方式进行管理,通过简要评估检查是否符合生产、标签以及质量标准。
特别提醒:澳大利亚已与欧盟达成互认协议。这意味着,合格评定证书由TGA颁发的也被欧盟认可,TGA也认可欧盟CE认证。已获CE认证的用户,可提交CE证书及相关资料,获得TGA证书。
如果产品已经注册或备案,制造商更换经销商对其没有影响。对国外产品进行注册审批后,每年还要常规注册

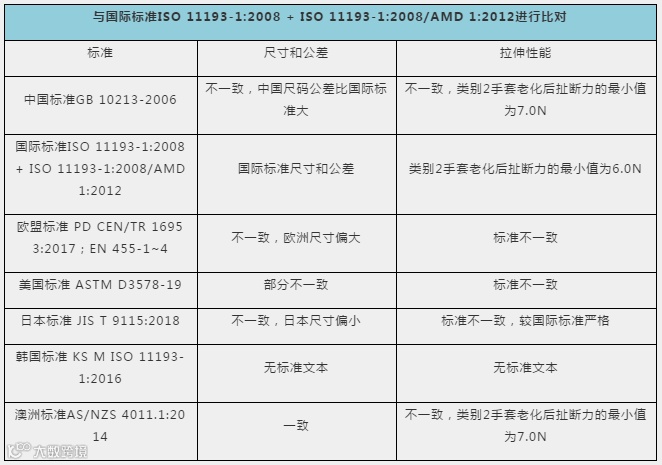




除表中列出的指标之外,在手套分类、所用材料等基本特性方面国际标准、各国国家标准普遍一致。
广州星美轮专注于发展特色服务
——危险品运输
①专业提供危险品海运、空运、ISO TANK、海事申报、陆运等进出口运输代理业务;
②承接货物的订舱,危险品申报以及进出口货物的报关、报检、保险、转运、仓储、中转、交接分拨、集装箱整柜拼箱、短途运输、门到门服务;
②承接3、4、5、6、8、9类危险品国际海运运输;
资料来源:海运网
由广州星美轮整理发布
免责声明:本文内容仅供阅读参考,具体以相应法规及当地行政机关判定为结果。本文所列准入条件、技术标准等为国内外政府机构、专业网站、新闻报道收集整理而成,仅供参考。如有动态调整具体以国内外主管机构官方解释、发布为准。






























